题目内容
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.【提出问题】催化剂能加快反应速率,但自身质量和化学性质不变.
【查阅资料】①已知KClO3分解产生氧气和KCl; ②KClO3和KCl都能溶于水,MnO2难溶于水;③MnO2与浓盐酸在加热时能产生黄绿色的Cl2.
【设计实验】
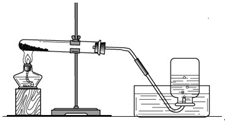
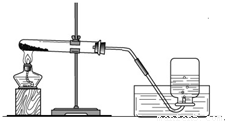
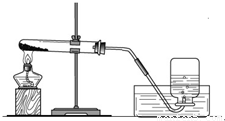
实验一、取两份质量相等(约5克)的KClO3分别放入两只大试管(分别标记A和B)中,往B试管中加入质量为1.0克MnO2的,然后按图所示组装好仪器,加热.结果发现加了MnO2的装置收集满一集气瓶的气体所用的时间要少.
实验二、待装置完全冷却之后,将B管中物质置于烧杯中加水溶解、过滤;再将滤出物干燥、称量得质量约为1.0克.
实验三、取少量滤出物与浓盐酸置于反应装置中(放在通风橱中),加热;有黄绿色气体产生.根据以上实验回答下列问题:
(1)实验一说明加了MnO2之后,KClO3分解的速率更快,写出这一反应的化学方程式:______△2KCl+3O2↑
【答案】分析:根据实验室制氧气的原理书写化学方程式;根据氧气的检验进行分析解答;
根据二氧化锰反应前后其质量和化学性质不变来解答;
根据高锰酸钾分解生成二氧化锰,二氧化锰可作氯酸钾分解的催化剂分析回答.
解答:解:(1)实验室用氯酸钾制取氧气的化学方程式为:2KClO3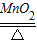 2KCl+3O2↑;检验氧气用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气;
2KCl+3O2↑;检验氧气用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气;
(2)通过分析上述三个实验知二氧化锰参与了化学反应,反应前后其质量和化学性质不变,二氧化锰起到催化作用;
(3)因为加热时高锰酸钾首先分解,生成锰酸钾、二氧化锰和氧气,其中二氧化锰对氯酸钾分解又会起催化作用,改变了氯酸钾分解生成氧气的速度.
故答案为:
(1)2KClO3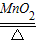 2KCl+3O2↑ 用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气;
2KCl+3O2↑ 用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气;
(2)二氧化锰在反应中起催化作用,加快了反应的速率,自身的质量和化学性质在化学反应前后没有发生变化;
(3)不对;加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用.
点评:本题主要考查对化学基本概念和原理的理解,体现化学学科考查以教材为根本的原则,符合中考方向;掌握氯酸钾和高锰酸钾的性质,理解催化剂的概念是解题的关键.
根据二氧化锰反应前后其质量和化学性质不变来解答;
根据高锰酸钾分解生成二氧化锰,二氧化锰可作氯酸钾分解的催化剂分析回答.
解答:解:(1)实验室用氯酸钾制取氧气的化学方程式为:2KClO3
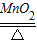 2KCl+3O2↑;检验氧气用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气;
2KCl+3O2↑;检验氧气用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气;(2)通过分析上述三个实验知二氧化锰参与了化学反应,反应前后其质量和化学性质不变,二氧化锰起到催化作用;
(3)因为加热时高锰酸钾首先分解,生成锰酸钾、二氧化锰和氧气,其中二氧化锰对氯酸钾分解又会起催化作用,改变了氯酸钾分解生成氧气的速度.
故答案为:
(1)2KClO3
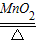 2KCl+3O2↑ 用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气;
2KCl+3O2↑ 用带火星的木条伸入到集气瓶中,木条复燃,证明收集的气体是氧气;(2)二氧化锰在反应中起催化作用,加快了反应的速率,自身的质量和化学性质在化学反应前后没有发生变化;
(3)不对;加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用.
点评:本题主要考查对化学基本概念和原理的理解,体现化学学科考查以教材为根本的原则,符合中考方向;掌握氯酸钾和高锰酸钾的性质,理解催化剂的概念是解题的关键.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
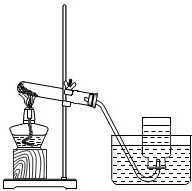 探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.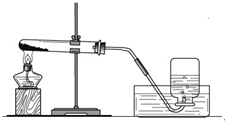 探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.
探究性实验是验证化学理论的一种主要方式,也展示了化学的无穷魅力.