题目内容
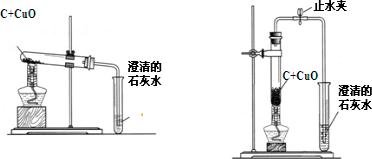
(2010?梧州)梧州市某中学化学兴趣小组按照课本实验方法(如图19甲),做木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现.他们决定对这个实验进行探究和改进.
【提出问题】暗红色的固体是什么?如何选择合适的条件,使木炭还原氧化铜的实验现象更明显?
【查阅资料】铜有+1和+2两种化合价,通常情况下,氧的化合价为-2,碳的化合价为+4或-4.
【猜想与假设】
(1)同学们认为这种暗红色固体可能是一种化合物,并猜测它的化学式为
(2)同学们还认为,通过改变反应物的状态、质量比,以及反应装置,可以使该实验现象更加明显,减少出现暗红色固体的情况.
【分析与交流】
(1)小吴建议用超细炭粉与氧化铜粉末进行实验.你认为这样建议的原理是
(2)小周建议用图19的乙装置替代甲装置.与甲相比较,乙装置中将试管直立放
置的作用是
(3)对下列三种氧化铜和碳的质量比例,小施建议选择
A. 32:3 B. 40:3 C. 48:3
你认为小施这样选择的理由是
【实验与结论】
同学们决定按改进后的方案进行实验,他们在检验了乙装置的
不久,即可看到试管底部变红热,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应是
待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却.若不关闭止水夹,可能出现的问题是

【提出问题】暗红色的固体是什么?如何选择合适的条件,使木炭还原氧化铜的实验现象更明显?
【查阅资料】铜有+1和+2两种化合价,通常情况下,氧的化合价为-2,碳的化合价为+4或-4.
【猜想与假设】
(1)同学们认为这种暗红色固体可能是一种化合物,并猜测它的化学式为
Cu2O(Cu4C、Cu2C)
Cu2O(Cu4C、Cu2C)
.(2)同学们还认为,通过改变反应物的状态、质量比,以及反应装置,可以使该实验现象更加明显,减少出现暗红色固体的情况.
【分析与交流】
(1)小吴建议用超细炭粉与氧化铜粉末进行实验.你认为这样建议的原理是
这是固体反应物间的反应,使用颗粒更小的反应物,可以增加表面积,有利于反应
的进行.
的进行.
这是固体反应物间的反应,使用颗粒更小的反应物,可以增加表面积,有利于反应
的进行.
.的进行.
(2)小周建议用图19的乙装置替代甲装置.与甲相比较,乙装置中将试管直立放
置的作用是
有利于集中加热,获得持续高温.
有利于集中加热,获得持续高温.
.(3)对下列三种氧化铜和碳的质量比例,小施建议选择
A
A
(填选项序号)的比例.A. 32:3 B. 40:3 C. 48:3
你认为小施这样选择的理由是
反应中炭粉会与试管内的氧气反应而部分消耗,故稍过量的炭粉有利于反应
的进行.
的进行.
反应中炭粉会与试管内的氧气反应而部分消耗,故稍过量的炭粉有利于反应
的进行.
.的进行.
【实验与结论】
同学们决定按改进后的方案进行实验,他们在检验了乙装置的
气密性
气密性
后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时,不能
不能
(填“可以”或“不能”)确定氧化铜和炭粉已经开始反应.不久,即可看到试管底部变红热,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应是
放
放
(填“吸”或“放”)热反应.待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却.若不关闭止水夹,可能出现的问题是
空气会进入反应的试管中,使生成的依然灼热的铜重新被氧化
空气会进入反应的试管中,使生成的依然灼热的铜重新被氧化
.待产物冷却后,同学们终于找到了期待已久的紫红色铜珠,实验获得了圆满成功.分析:在明确探究目的在基础上,仔细阅读所给的信息,猜测化学式时应根据化合物中元素的化合价代数和为零的原则;物质接触面积越大反应就越充分,用超细炭粉与氧化铜粉末反应是合理的;乙装置中将试管直立放置的作用是有利于反应物受热,在选择氧化铜和碳的质量比例时要考虑到氧气消耗的炭,所以石灰水开始变浑浊是不能说明氧化铜和碳发生了反应,反应结束后要关闭止水夹,防止进入空气,使灼热的铜再被氧化.
解答:解:【猜想与假设】中,因为铜有+1和+2两种化合价,通常情况下,氧的化合价为-2,碳的化合价为+4或-4.根据化合物中元素的化合价代数和为零的原则,暗红色固体的化学式可能为:Cu2O(Cu4C、Cu2C)
【分析与交流】
(1)物质接触面积越大反应就越充分,故答案为:使用颗粒更小的反应物,可以增加表面积,有利于反应的进行.
(2)乙装置中将试管直立放置更有利于集中加热,并能利用反应放出的热量,答案为:是有利于集中加热,获得持续高温.
(3)在选择氧化铜和碳的质量比例时要考虑到氧气消耗的炭,不能按反应的比例选择,碳粉要稍多一些,有利于反应充分进行,答案为:A 反应中炭粉会与试管内的氧气反应而部分消耗,故稍过量的炭粉有利于反应的进行.
【实验与结论】
实验时首先要检查装置的气密性,当看到澄清的石灰水刚出现浑浊时,可能是炭也氧气反应生成的二氧化碳,故不能判断碳一氧化铜发生了反应,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应要放出热量,反应结束后要关闭止水夹,防止进入空气,使灼热的铜再被氧化.
故答案为:不能 放 空气会进入反应的试管中,使生成的依然灼热的铜重新被氧化.
【分析与交流】
(1)物质接触面积越大反应就越充分,故答案为:使用颗粒更小的反应物,可以增加表面积,有利于反应的进行.
(2)乙装置中将试管直立放置更有利于集中加热,并能利用反应放出的热量,答案为:是有利于集中加热,获得持续高温.
(3)在选择氧化铜和碳的质量比例时要考虑到氧气消耗的炭,不能按反应的比例选择,碳粉要稍多一些,有利于反应充分进行,答案为:A 反应中炭粉会与试管内的氧气反应而部分消耗,故稍过量的炭粉有利于反应的进行.
【实验与结论】
实验时首先要检查装置的气密性,当看到澄清的石灰水刚出现浑浊时,可能是炭也氧气反应生成的二氧化碳,故不能判断碳一氧化铜发生了反应,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应要放出热量,反应结束后要关闭止水夹,防止进入空气,使灼热的铜再被氧化.
故答案为:不能 放 空气会进入反应的试管中,使生成的依然灼热的铜重新被氧化.
点评:完成实验探究题时,要明确探究的目的,根据所给信息按步骤进行分析,认真思考反应中的现象,不放过细节问题.

练习册系列答案
相关题目