题目内容
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量记录如下:| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线(见答题卡).
分析:向硫酸和硫酸铜的混合溶液滴加氢氧化钠溶液,硫酸、硫酸铜都可与氢氧化钠发生反应,由于硫酸的存在氢氧化钠与硫酸铜不能生成氢氧化铜沉淀,待硫酸反应完才能产生氢氧化铜沉淀;所以记录数据中,加入50.0g氢氧化钠溶液时产生沉淀的质量为0;而在加入氢氧化钠溶液200.0g以后沉淀质量不再变化,说明硫酸铜也已完全反应,故生成沉淀量最大值为9.8g;
根据硫酸铜与氢氧化钠反应的化学方程式,由沉淀氢氧化铜的质量可计算混合溶液中硫酸铜的质量及与硫酸铜发生反应的氢氧化钠的质量;
根据硫酸与氢氧化钠反应的化学方程式,由混合溶液中硫酸的质量计算与之发生反应的氢氧化钠的质量;
利用与硫酸及硫酸铜反应的氢氧化钠的质量和与氢氧化钠溶液的溶质质量分数的比可计算所加氢氧化钠溶液的质量.
根据硫酸铜与氢氧化钠反应的化学方程式,由沉淀氢氧化铜的质量可计算混合溶液中硫酸铜的质量及与硫酸铜发生反应的氢氧化钠的质量;
根据硫酸与氢氧化钠反应的化学方程式,由混合溶液中硫酸的质量计算与之发生反应的氢氧化钠的质量;
利用与硫酸及硫酸铜反应的氢氧化钠的质量和与氢氧化钠溶液的溶质质量分数的比可计算所加氢氧化钠溶液的质量.
解答:解:(1)由记录数据表可知,至硫酸铜完全反应共生成蓝色沉淀9.8g;
根据化学变化前后元素质量不变,混合溶液中硫酸铜的质量=
=16.0g
故答案为:9.8;16.0;
(2)设与硫酸反应的氢氧化钠的质量为x,与硫酸铜反应的氢氧化钠的质量为y
H2SO4+2NaOH═Na2SO4+2H2O
98 80
9.8g x
=
x=8.0g
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
80 98
y 9.8g
=
y=8g
故参加反应的氢氧化钠溶液的质量=
=160g
答:整个过程中参加反应的氢氧化钠溶液的总质量是160克;
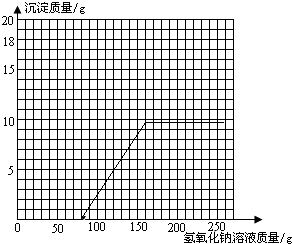
(3)抓住起点、折点及曲线走势,曲线起点:硫酸被完全反应后氢氧化钠与硫酸铜反应生成蓝色氢氧化铜沉淀,此时所加入氢氧化钠溶液的质量=
=80g;
曲线折点:溶液中硫酸铜完全反应后再加入氢氧化钠溶液沉淀氢氧化铜不再增加,此时所加入氢氧化钠溶液的质量=160g;
曲线走势:加入160g氢氧化钠溶液后,硫酸铜完全反应,随后再加入的氢氧化钠溶液不再发生反应,沉淀氢氧化铜质量不变;
故答案为:
根据化学变化前后元素质量不变,混合溶液中硫酸铜的质量=
9.8g×
| ||
|
故答案为:9.8;16.0;
(2)设与硫酸反应的氢氧化钠的质量为x,与硫酸铜反应的氢氧化钠的质量为y
H2SO4+2NaOH═Na2SO4+2H2O
98 80
9.8g x
| 98 |
| 9.8g |
| 80 |
| x |
x=8.0g
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
80 98
y 9.8g
| 80 |
| y |
| 98 |
| 9.8g |
y=8g
故参加反应的氢氧化钠溶液的质量=
| 8g+8g |
| 10% |
答:整个过程中参加反应的氢氧化钠溶液的总质量是160克;
(3)抓住起点、折点及曲线走势,曲线起点:硫酸被完全反应后氢氧化钠与硫酸铜反应生成蓝色氢氧化铜沉淀,此时所加入氢氧化钠溶液的质量=
| 8.0g |
| 10% |
曲线折点:溶液中硫酸铜完全反应后再加入氢氧化钠溶液沉淀氢氧化铜不再增加,此时所加入氢氧化钠溶液的质量=160g;
曲线走势:加入160g氢氧化钠溶液后,硫酸铜完全反应,随后再加入的氢氧化钠溶液不再发生反应,沉淀氢氧化铜质量不变;
故答案为:

点评:在解答涉及反应曲线类问题时,要注意曲线起点、折点的特殊意义,起点为反应开始发生、折点则是该反应恰好完全反应.

练习册系列答案
相关题目
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入10%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为 g,该混合溶液中硫酸铜的质量为 g.
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)
| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.45 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少克?(要求写出计算过程)