题目内容
【题目】根据下列实验装置图,回答有关问题。
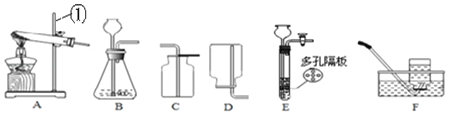
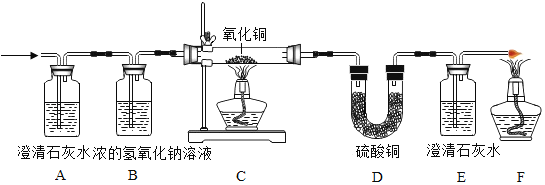
(1)写出(1)标号①的仪器名称:①_____。
(2)用大理石和稀盐酸制取二氧化碳,可选用的装置组合为_____,E装置相对于B装置有的优点是_____;请写出该反应的化学方程式_____。
(3)稀盐酸可用于铁制品表面除锈,观察到的现象是_____,写出该反应的化学方程式_____,除锈时注意不能长时间放在稀盐酸中,原因是_____(用方程式表示)。
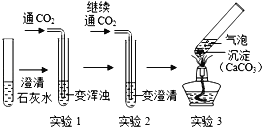
(4)为了验证二氧化碳与氢氧化钠可以发生化学反应,某兴趣小组用如图所示装置进行实验,请分析回答下列问题:
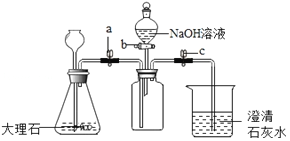
①打开止水夹a和c,关闭b,从长颈漏斗中加入足量的稀盐酸,当观察到澄清石灰水变浑浊时,说明集气瓶中已集满二氧化碳气体,然后待锥形瓶中反应停止后,关闭a,打开b,滴入足量氢氧化钠溶液后关闭活塞b,一段时间后可观察到_____,证明二氧化碳与氢氧化钠发生了化学反应,写出该反应的化学方程式_____。
②小红认为仅做上述实验有不足之处,可再利用如图装置做一个对比实验即可证明,该对比实验只需将所用的氢氧化钠溶液换成_____即可。
③小明认为要想证明二氧化碳与氢氧化钠溶液确实发生了反应,也可取反应后的溶液少许,滴加_____,根据现象即可判断。
【答案】铁架台 BC 可以控制反应的发生和停止 CaCO3+2HCl═CaCl2+H2O+CO2↑ 铁锈逐渐消失,溶液变为黄色 Fe2O3+6HCl═2FeCl3+3H2O Fe+2HCl═FeCl2+H2↑ 石灰水倒吸至集气瓶中 CO2+2NaOH═Na2CO3+H2O 水 稀盐酸
【解析】
解:(1)通过分析题中所指仪器的名称和作用可知,①是铁架台;
(2)实验室制取二氧化碳的反应物是固体和液体,反应条件是常温,二氧化碳密度比空气大,不易溶于水,可选用的装置组合为BC,E装置可以通过装置内压强的改变实现固体和液体的分离,所以E装置相对于B装置有的优点是可以控制反应的发生和停止,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)氧化铁和盐酸反应生成氯化铁和水,铁和盐酸反应生成氯化亚铁和氢气,所以稀盐酸可用于铁制品表面除锈,观察到的现象是铁锈逐渐消失,溶液变为黄色,化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O,除锈时注意不能长时间放在稀盐酸中,原因是:Fe+2HCl═FeCl2+H2↑;
(4)①氢氧化钠和二氧化碳反应生成碳酸钠和水,所以一段时间后可观察到石灰水倒吸至集气瓶中,证明二氧化碳与氢氧化钠发生了化学反应,化学方程式为:CO2+2NaOH═Na2CO3+H2O;
②可再利用如图装置做一个对比实验即可证明,该对比实验只需将所用的氢氧化钠溶液换成水即可;
③碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,所以要想证明二氧化碳与氢氧化钠溶液确实发生了反应,也可取反应后的溶液少许,滴加稀盐酸,根据现象即可判断。
故答案为:(1)铁架台;(2)BC,可以控制反应的发生和停止,CaCO3+2HCl═CaCl2+H2O+CO2↑;(3)铁锈逐渐消失,溶液变为黄色,Fe2O3+6HCl═2FeCl3+3H2O,Fe+2HCl═FeCl2+H2↑;(4)①石灰水倒吸至集气瓶中,CO2+2NaOH═Na2CO3+H2O;②水;③稀盐酸。

 考前必练系列答案
考前必练系列答案【题目】某兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了塞上瓶塞.这瓶溶液有没有变质呢?同学们想一探究竟,请你和他们一起参与.
(查阅资料)氯化钡溶液显中性.
(提出猜想)假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液_____变质.
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
①取少量该溶液于试管中,向其中滴加过量的氯化钡溶液; | 生成白色沉淀 | 假设_____不成立 |
②静置,向上层清液中滴加酚酞溶液. | _____ | 假设二成立 |
(讨论交流)
(1)步骤①滴加过量的氯化钡溶液的目的是_____;
(2)有同学提出用氢氧化钡溶液代替氯化钡溶液做同样的实验,也能看到相同的现象,得出相同的结论.你同意他的观点吗?为什么?_____.
(反思)氢氧化钠敞口放置变质的原因是_____(用化学方程式表示),因此氢氧化钠应_____保存.