题目内容
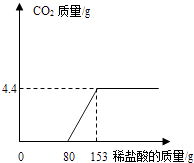
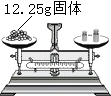
【题目】现将15g含有氧化铜、氧化亚铁、炭粉和锌粉的黑色固体混合物溶于50g未知浓度的稀硫酸中,充分反应后,过滤得到溶液60g,剩余固体4.8g,则以下推理正确的是( )
A.该稀硫酸的溶质质量分数不低于19.6%
B.若溶液为无色,则溶液中的溶质可能是硫酸锌和硫酸
C.若溶液为无色,则剩余固体可能是炭、铜和铁的混合物
D.若溶液为浅绿色,则剩余固体一定是炭和铜的混合物
【答案】AC
【解析】解:A、根据反应前后物质的质量变化可知该反应生成了氢气,其质量是15g+50g﹣60g﹣4.8g=0.2g;根据黑色混合物的信息可知生成的氢气只能是由锌与硫酸反应制得; 设生成氢气0.2g需要硫酸的质量为x,则有
Zn+H2SO4═ZnSO4+ | H2↑ |
98 | 2 |
X | 0.2g |
![]()
解得:x=9.8g
该稀硫酸中溶质的质量分数最小为: ![]() ×100%=19.6%
×100%=19.6%
由于该反应中硫酸可能没有完全反应,所以根据刚才的计算可以知道该硫酸溶液的质量分数最小是为19.6%.
B、若溶液为无色,推出溶液中无有色的Fe2+、Cu2+ , 则铁元素 铜元素只能在剩余的固体中,所以固体中有Fe则溶液中不会有H2SO4(会与铁反应);
C、若溶液为无色,推出溶液中没有有色的Fe2+ , Cu2+ , 则铁元素 铜元素反应后只能在剩余的固体中,所以固体中有Fe Cu,另外还一定有不反应的C;
D、若溶液为浅绿色,则溶液中有Fe2+ , 但也有可能固体中也有Fe,所以题目中说“一定”是错的;
故选AC
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目