题目内容
某可溶物ag投入(100-a)g水中充分溶解,所得溶液溶质质量分数为
- A.大于a%
- B.等于a%
- C.小于a%
- D.无法确定
D
分析:根据可溶物溶于水,可利用不同可溶物来分析其质量分数,利用溶质和溶液质量的来分析质量分数.
解答:若可溶物与水不反应,则溶质质量为ag,溶液质量为ag+(100-ag=100g,所得溶液溶质质量分数为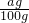 ×100%=a%;
×100%=a%;
若可溶物与水反应,如Na2O与水反应生成氢氧化钠,溶质质量将大于ag,溶液质量为ag+(100-ag=100g,所得溶液溶质质量分数>a%;
若物质含结晶水,如CuSO4?5H2O溶于水后溶质为硫酸铜,则溶质的质量将小于ag,溶液质量为ag+(100-ag=100g,所得溶液溶质质量分数<a%;
则所得溶液溶质质量分数为无法确定,
故选D.
点评:本题较难,也容易出错,易错选B,学生应明确不同的可溶物其计算结果不同,把握可溶物是解答的关键,若涉及溶质和溶液质量都在变化的计算会更复杂些,如金属钠与水反应等.
分析:根据可溶物溶于水,可利用不同可溶物来分析其质量分数,利用溶质和溶液质量的来分析质量分数.
解答:若可溶物与水不反应,则溶质质量为ag,溶液质量为ag+(100-ag=100g,所得溶液溶质质量分数为
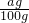 ×100%=a%;
×100%=a%;若可溶物与水反应,如Na2O与水反应生成氢氧化钠,溶质质量将大于ag,溶液质量为ag+(100-ag=100g,所得溶液溶质质量分数>a%;
若物质含结晶水,如CuSO4?5H2O溶于水后溶质为硫酸铜,则溶质的质量将小于ag,溶液质量为ag+(100-ag=100g,所得溶液溶质质量分数<a%;
则所得溶液溶质质量分数为无法确定,
故选D.
点评:本题较难,也容易出错,易错选B,学生应明确不同的可溶物其计算结果不同,把握可溶物是解答的关键,若涉及溶质和溶液质量都在变化的计算会更复杂些,如金属钠与水反应等.

练习册系列答案
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
某可溶物ag投入(100-a)g水中充分溶解,所得溶液溶质质量分数为( )
| A、大于a% | B、等于a% | C、小于a% | D、无法确定 |