题目内容
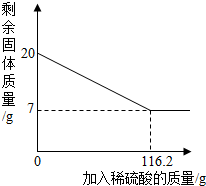 (2012?贵港一模)为测定黄铜(由锌、铜形成的合金)样品中铜的质量分数,往样品中加入稀硫酸充分反应,所加稀硫酸与剩余固体质量关系如图所示.
(2012?贵港一模)为测定黄铜(由锌、铜形成的合金)样品中铜的质量分数,往样品中加入稀硫酸充分反应,所加稀硫酸与剩余固体质量关系如图所示.(1)样品中铜的质量分数;
(2)恰好完全反应时,所得溶液中溶质的质量分数.
分析:(1)运用黄铜中锌能和稀硫酸反应,铜不和稀硫酸反应,剩余固体都是铜,结合图象即可得出铜的质量为7g解答.
(2)根据锌和稀硫酸反应的化学方程式求出所得溶液中溶质硫酸锌的质量32.2g、生成氢气的质量0.4g;然后根据质量守恒定律求出所得溶液的质量:13g+116.2g-0.4g=128.8g;然后根据所得溶液溶质质量分数=
×100%
(2)根据锌和稀硫酸反应的化学方程式求出所得溶液中溶质硫酸锌的质量32.2g、生成氢气的质量0.4g;然后根据质量守恒定律求出所得溶液的质量:13g+116.2g-0.4g=128.8g;然后根据所得溶液溶质质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)样品中铜的质量分数=
×100%=35%
(2)设反应生成的硫酸锌的质量为x,生成氢气的质量为y,由图可知样品中锌的质量为20g-7g=13g
Zn+H2SO4=ZnSO4+H2↑
65 161 2
13g x y
=
x=32.2g
=
y=0.4g
恰好完全反应时所得溶液中溶质的质量分数=
×100%=25%(2分)
答:样品中铜的质量分数为35%,恰好完全反应时所得溶液的溶质质量分数为25%.
| 7g |
| 20g |
(2)设反应生成的硫酸锌的质量为x,生成氢气的质量为y,由图可知样品中锌的质量为20g-7g=13g
Zn+H2SO4=ZnSO4+H2↑
65 161 2
13g x y
| 65 |
| 13g |
| 161 |
| x |
x=32.2g
| 65 |
| 13g |
| 2 |
| y |
恰好完全反应时所得溶液中溶质的质量分数=
| 32.2g |
| 13+116.2g-0.4g |
答:样品中铜的质量分数为35%,恰好完全反应时所得溶液的溶质质量分数为25%.
点评:本题主要考查化学方程式的书写和有关化学方程式的计算,结合数学图象解答,难度较大.注意:注意标明气体;计算要细心、准确.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
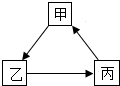 (2012?贵港一模)甲、乙、丙为初中化学常见物质,甲是石灰石的主要成分,它们有如图所示转化关系:
(2012?贵港一模)甲、乙、丙为初中化学常见物质,甲是石灰石的主要成分,它们有如图所示转化关系: