题目内容
【题目】有A、B、C、D四种元素,其原子结构示意图表示如图:
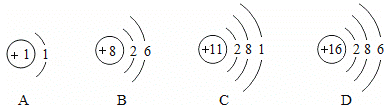
(1)D元素的名称为______,D元素与图中______(填写字母序号)元素的化学性质相似,D元素的离子符号为______。
(2)A、B、C三种元素能形成一种化合物,其水溶液pH______7 (填>、<、=)。
(3)A、B两种元素的原子以1:1的比例形成的化合物为(写化学式)______,其中B元素化合价为______。
【答案】 硫 B S2﹣ > H2O2 ﹣1
【解析】本题主要考查原子结构示意图与离子结构示意图。在原子中,核内质子数=核外电子数,金属元素的原子最外层电子数通常小于4,非金属元素的原子最外层电子数通常大于4个,稀有气体原子的最外层电子数通常是8个,据此解答
(1)核内质子数=核外电子数=16,属于硫原子,是硫元素,故填:硫
最外层电子数决定化学性质,DB的最外层电子都是6个,所以化学性质相似。故填:B
D最外层有6个电子,易得2个电子,形成的离子是:S2﹣
(2)A是氢元素,B是氧元素,C是钠元素,形成的化合物是氢氧化钠,属于碱,所以PH >7,故填:>
(3)A是氢元素,B是氧元素,所以1:1的比例形成的化合物为过氧化氢,化学式为H2O2 氢为+1价,根据化合物中正负化合价的和为零,所以氧的化合价为-1价。故填:﹣1

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目