题目内容
【题目】某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2 .
(1)配制100g 10%稀盐酸需要37%浓盐酸(密度1.19g/cm3)的体积为mL(结果保留小数点后一位).除了胶头滴管、烧杯外还需要的玻璃仪器是、 .
(2)6.5g粗锌完全反应共产生H2的质量为0.16g,则该粗锌中锌的质量分数为 .
(3)验证后用装满水的10mL量筒代替小试管收集H2 , 装置如图所示. ①10mL量筒的最大刻度靠近端.(填写“M”或“N”)
②当10mL量筒中的水全部被排尽后,实际收集到的H2体积V10.0mL.(填写“>”、“=”或“<”)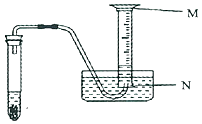
【答案】
(1)22.1;量筒;玻璃棒
(2)80%
(3)N;>
【解析】解:(1)解:设需38%的盐酸的体积为x 100g×10%=38%×1.19g/cm3×x
x=22.1cm3=22.1mL
稀释过程中,除了胶头滴管、烧杯外还需要的玻璃仪器量筒、玻璃棒;
所以答案是:22.1;量筒;玻璃棒;(2)解:设所需锌的质量为y,则
Zn+2HCl=ZnCl2+ | H2↑ |
65 | 2 |
y | 0.16g |
![]()
y=5.2g
则该粗锌中锌的质量分数为 ![]() =80%
=80%
所以答案是:80%;(3)①量筒上的刻度由下到上是由小到大;所以答案是:N;②10mL量筒上10mL的刻度并不是在最上缘,也就是当10mL量筒中的水全部被排尽后,实际收集到的H2体积大于10.0mL;所以答案是:>.
【考点精析】利用氢气的制取和检验和根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知氢气的实验室制法原理:Zn + H2SO4 = ZnSO4 +H2↑;Zn + 2HCl = ZnCl2 +H2↑不可用浓盐酸的原因 浓盐酸有强挥发性 ;不可用浓硫酸或硝酸的原因 浓硫酸和硝酸有强氧化性;各物质间质量比=系数×相对分子质量之比.

 阅读快车系列答案
阅读快车系列答案