题目内容
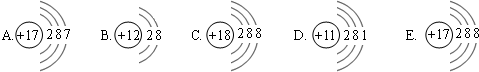
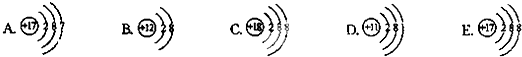
下面是五种粒子的结构示意图:

(1)图中粒子共能表示
(2)元素的化学性质与原子结构中的
(3)图中表示的阳离子是

(1)图中粒子共能表示
四
四
种元素.A所表示的元素位于元素周期表的第三
三
周期.(2)元素的化学性质与原子结构中的
最外层电子
最外层电子
数关系密切;(3)图中表示的阳离子是
Mg2+
Mg2+
(用离子符号表示),表示的阴离子是Cl-
Cl-
(用离子符号表示),二者形成的化合物的化学式为MgCl2
MgCl2
.分析:(1)根据质子数决定元素种类进行解答;
(2)根据元素的化学性质与原子结构中的最外层电子数关系密切进行解答;
(3)根据阳离子中质子数大于核外电子数以及阴离子中质子数小于核外电子数进行解答;
(2)根据元素的化学性质与原子结构中的最外层电子数关系密切进行解答;
(3)根据阳离子中质子数大于核外电子数以及阴离子中质子数小于核外电子数进行解答;
解答:解:(1)质子数相同,为同种元素,故上图中表示四种元素,A和E质子数相同都为17,都是氯元素,氯元素位于元素周期表的第三周期.
(2)元素的化学性质与原子结构中的最外层电子数关系密切;
(3)阳离子中质子数大于核外电子数而阴离子中质子数小于核外电子数,所以B是阳离子,是镁离子,离子符号为:Mg2+;E是阴离子,为氯离子,离子符号为:Cl-;其中镁元素的化合价为+2价,氯元素的化合价为-1价,所以二者形成的化合物的化学式为MgCl2.
故答案为:(1)四;三;(2)最外层电子;(3)Mg2+;Cl-;MgCl2.
(2)元素的化学性质与原子结构中的最外层电子数关系密切;
(3)阳离子中质子数大于核外电子数而阴离子中质子数小于核外电子数,所以B是阳离子,是镁离子,离子符号为:Mg2+;E是阴离子,为氯离子,离子符号为:Cl-;其中镁元素的化合价为+2价,氯元素的化合价为-1价,所以二者形成的化合物的化学式为MgCl2.
故答案为:(1)四;三;(2)最外层电子;(3)Mg2+;Cl-;MgCl2.
点评:本题主要考查原子结构示意图的意义、掌握核内质子数和核外电子数的关系,学会区别阳离子、阴离子、原子的微粒的电子层排布特点.

练习册系列答案
相关题目