题目内容
某校化学兴趣小组的同学利用如图所示装置进行实验.
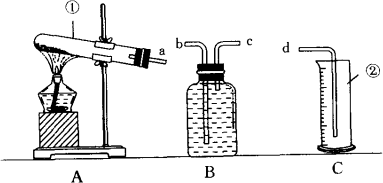
(1)实验目的:
①用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验.
②粗略测定加热2 g高锰酸钾所收集到的氧气体积.
(2)反应原理:(用文字表达式表示)
①高锰酸钾制氧气:________;
②细铁丝在氧气中燃烧:________.
(3)仪器认识:写出仪器名称:①________;②________.
(4)装置连接:
为达到实验目的②,各装置的正确连接顺序是:(填字母)
a→( )( )→d
(5)问题分析:
①实验过程中发现B瓶中的水变红了,原因是________.
②用收集到的氧气做细铁丝燃烧实验时,发现瓶底炸裂,产生这种结果的操作原因可能是________.
③根据化学方程式可计算出理论上2 g高锰酸钾完全分解可以生成氧气0.203 g,而实际测得氧气在标准状况下的体积为177 mL,换算成质量为0.253 g,超过理论量:0.253 g-0.203 g=0.05 g.从理论上推测,你认为超过理论量的氧气可能来源于什么物质?________.(写出所有可能,空气、水的因素忽略不计)
解析:
|
答案:(2)①高锰酸钾 分析:本题为了达到实验目的,测定氧气的体积,应该a接c,因为氧气不易溶于水,气体由c进入B瓶后,从上面压水,把水从b管压入量筒,测量排出水的体积即为氧气的体积.加热高锰酸钾时需在试管口放一团棉花,否则气流会把高锰酸钾吹入导管,由导管再进入水中,结果B瓶中的水变红了.由于铁丝燃烧时放出大量的热,并生成黑色的四氧化三铁固体,热的高温熔化物溅落,就容易炸裂集气瓶底.2 g高锰酸钾完全分解制得氧气的理论值是0.203 g,而实际制得氧气的质量是0.253 g,那么,氧气的来源必须是含氧的物质,空气和水又忽略不计,那么就有可能是高锰酸钾分解生成的锰酸钾、二氧化锰又继续分解了. |

步骤1.用一支大试管取一定量淀粉与水混合,再加入适量的稀硫酸,摇匀,加热到一定的温度.实验过程中,各人控制温度不同,加热持续时间相同.
步骤2.然后用两支小试管各取少量大试管内的反应混合物,在其中一支小试管(编号为A)内滴加NaOH溶液至呈强碱性,再滴入4-5滴CuS04溶液,并加热至沸;在另一支小试管(编号为B)内滴加2-3滴碘水.观察并记录现象.
(1)由于各人控制的温度不同,出现了下列三种情况.请你根据已学知识,帮助他们完成下列实验情况汇总表.
| 现 象 | 结 论 | |
| 第一种 情 况 | A试管中: B试管中: | 淀粉没有转化为葡萄糖 |
| 第二种 情 况 | A试管中: B试管中: | |
| 第三种 情 况 | A试管中: B试管中: | 淀粉全部转化为葡萄糖 |
步骤1.用一支大试管取一定量淀粉与水混合,再加入适量的稀硫酸,摇匀,加热到一定的温度.实验过程中,各人控制温度不同,加热持续时间相同.
步骤2.然后用两支小试管各取少量大试管内的反应混合物,在其中一支小试管(编号为A)内滴加NaOH溶液至呈强碱性,再滴入4-5滴CuS04溶液,并加热至沸;在另一支小试管(编号为B)内滴加2-3滴碘水.观察并记录现象.
(1)由于各人控制的温度不同,出现了下列三种情况.请你根据已学知识,帮助他们完成下列实验情况汇总表.
| 现 象 | 结 论 | |
| 第一种 情 况 | A试管中: B试管中: | 淀粉没有转化为葡萄糖 |
| 第二种 情 况 | A试管中: B试管中: | |
| 第三种 情 况 | A试管中: B试管中: | 淀粉全部转化为葡萄糖 |
