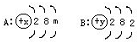题目内容
 如图是A、B两种元素的原子结构示意图:
如图是A、B两种元素的原子结构示意图:(1)A中m=7,则x=
17
17
;(2)A、B两种元素形成的化合物的化学式是
MgCl2
MgCl2
.分析:(1)根据核内质子数等于核外电子数考虑本题;(2)根据元素最外层电子数推出该元素的化合价,再根据化学式的写法考虑.
解答:解:(1)核外电子数:2+8+7=17,因为核内质子数等于核外电子数所以X为17;
(2)A是质子数是17 所以为氯元素,因为最外层电子数为7,易得到1个电子,显-1价;B核内质子数为2+8+2=12属于镁元素,最外层电子数为2,所以易失去两个电子,显+2价,正价在前,负价在后十字交叉再约简,所以化学式为MgCl2 .
故答案为:(1)17 (2)MgCl2
(2)A是质子数是17 所以为氯元素,因为最外层电子数为7,易得到1个电子,显-1价;B核内质子数为2+8+2=12属于镁元素,最外层电子数为2,所以易失去两个电子,显+2价,正价在前,负价在后十字交叉再约简,所以化学式为MgCl2 .
故答案为:(1)17 (2)MgCl2
点评:解答本题关键是要知道根据在外层电子数求化合价的方法:得几个电子显负几价,失去几个电子显正几价.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目

 按要求完成下列填空:
按要求完成下列填空: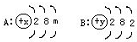 如图是A、B两种元素的原子结构示意图:
如图是A、B两种元素的原子结构示意图: