题目内容
(2011?牡丹江)小冉和小海两位同学在实验室中进行化学实验.小冉将CO2通入澄清的石灰水中;小海向盛有少量NaOH溶液的试管中滴入几滴酚酞溶液,再倒入一定量的稀盐酸.
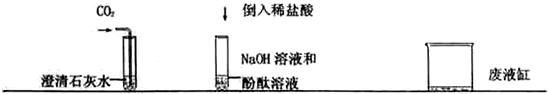
(1)小冉同学观察到的现象
(2)小海同学实验后发现试管内溶液为无色,认为氢氧化钠和盐酸恰好完全反应.你认为他的观点是否正确
(3)实验结束后,两名同学将反应后的剩余物同时倒入废液缸中,发现有气泡产生,废液仍然为无色.请你和两名同学一起对废液缸中废液的组成进行探究.
【提出问豫】废液中的溶质除指示剂外,还有什么?
【进行猜想】①两位同学一致认为溶质为CaCl2和NaCl:
②你认为溶质的组成还可能为
【实验验证】向废液中加入
【实验结论】说明猜想
【实验反思】为减少废液对环境的污染,可采取的方法是
【拓展延伸】通过酚酞溶液由红色变无色,说明NaOH已与盐酸完全反应,你认为还可以向反应后的溶液中加入

(1)小冉同学观察到的现象
澄清石灰水变浑浊
澄清石灰水变浑浊
,该反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
;(2)小海同学实验后发现试管内溶液为无色,认为氢氧化钠和盐酸恰好完全反应.你认为他的观点是否正确
否
否
(填“是”或“否”),你的理由是:若盐酸有剩余,酚酞溶液也不变色
若盐酸有剩余,酚酞溶液也不变色
;(3)实验结束后,两名同学将反应后的剩余物同时倒入废液缸中,发现有气泡产生,废液仍然为无色.请你和两名同学一起对废液缸中废液的组成进行探究.
【提出问豫】废液中的溶质除指示剂外,还有什么?
【进行猜想】①两位同学一致认为溶质为CaCl2和NaCl:
②你认为溶质的组成还可能为
CaCl2、NaCl和HCl
CaCl2、NaCl和HCl
.【实验验证】向废液中加入
锌粒
锌粒
,出现有气泡产生
有气泡产生
现象.【实验结论】说明猜想
②
②
(填①或②)正确.【实验反思】为减少废液对环境的污染,可采取的方法是
净化后排放
净化后排放
.【拓展延伸】通过酚酞溶液由红色变无色,说明NaOH已与盐酸完全反应,你认为还可以向反应后的溶液中加入
硫酸铜溶液
硫酸铜溶液
(不使用紫色石蕊试液和pH试纸)来证明NaOH确已完全反应.分析:(1)二氧化碳通入澄清石灰水中生成碳酸钙沉淀而变浑浊.
(2)根据盐酸加入到氢氧化钠中生成物可能有三种情况,恰好反应,盐酸过量,氢氧化钠过量来综合分析.
(3)【进行猜想】根据题意所给现象两种物质混合后有气泡产生,说明原来盐酸过量,来推测混合后的反应情况.
【实验验证】根据猜想一和二的区别就是是否含有盐酸,所以可以根据盐酸的性质来选择试剂,使盐酸有现象,而氯化钙和氯化钠没有现象即可.若加锌粉或碳酸钠等
【实验结论】若产生和盐酸反应的现象就证明猜想二正确,否则猜想一正确.
【实验反思】根据保护环境进行思考.
【拓展延伸】也可从氢氧化钠角度进行鉴别.
(2)根据盐酸加入到氢氧化钠中生成物可能有三种情况,恰好反应,盐酸过量,氢氧化钠过量来综合分析.
(3)【进行猜想】根据题意所给现象两种物质混合后有气泡产生,说明原来盐酸过量,来推测混合后的反应情况.
【实验验证】根据猜想一和二的区别就是是否含有盐酸,所以可以根据盐酸的性质来选择试剂,使盐酸有现象,而氯化钙和氯化钠没有现象即可.若加锌粉或碳酸钠等
【实验结论】若产生和盐酸反应的现象就证明猜想二正确,否则猜想一正确.
【实验反思】根据保护环境进行思考.
【拓展延伸】也可从氢氧化钠角度进行鉴别.
解答:解:(1)二氧化碳通入澄清石灰水中生成碳酸钙沉淀和水,CO2+Ca(OH)2=CaCO3↓+H2O,致使溶液变浑浊.故答案为:澄清石灰水变浑浊; CO2+Ca(OH)2=CaCO3↓+H2O
(2)盐酸加入到氢氧化钠中生成物可能有三种情况,恰好反应呈中性,滴加酚酞不变色,盐酸过量溶液呈酸性,滴加酚酞也不变色,氢氧化钠过量溶液呈碱性,滴加酚酞变红色,所以溶液不变色不能说明恰好反应完.故答案为:否; 若盐酸有剩余,酚酞溶液也不变色
(3)【进行猜想】由题意所给现象“将反应后的剩余物同时倒入废液缸中,发现有气泡产生,废液仍然为无色.”两种物质混合后有气泡产生,说明原来盐酸过量,来推测混合后的反应情况.故答案为:CaCl2、NaCl和HCl
【实验验证】根据猜想一和二的区别就是是否含有盐酸,所以可以根据盐酸的性质来选择试剂,使盐酸有现象,而氯化钙和氯化钠没有现象即可.若加锌粉或碳酸钠等故答案为:锌粒; 有气泡产生
【实验结论】若产生和盐酸反应的现象就证明猜想二正确,否则猜想一正确.故答案为:②
【实验反思】根据保护环境进行思考.故答案为:净化后排放
【拓展延伸】也可从氢氧化钠角度进行鉴别.故答案为:硫酸铜溶液
(2)盐酸加入到氢氧化钠中生成物可能有三种情况,恰好反应呈中性,滴加酚酞不变色,盐酸过量溶液呈酸性,滴加酚酞也不变色,氢氧化钠过量溶液呈碱性,滴加酚酞变红色,所以溶液不变色不能说明恰好反应完.故答案为:否; 若盐酸有剩余,酚酞溶液也不变色
(3)【进行猜想】由题意所给现象“将反应后的剩余物同时倒入废液缸中,发现有气泡产生,废液仍然为无色.”两种物质混合后有气泡产生,说明原来盐酸过量,来推测混合后的反应情况.故答案为:CaCl2、NaCl和HCl
【实验验证】根据猜想一和二的区别就是是否含有盐酸,所以可以根据盐酸的性质来选择试剂,使盐酸有现象,而氯化钙和氯化钠没有现象即可.若加锌粉或碳酸钠等故答案为:锌粒; 有气泡产生
【实验结论】若产生和盐酸反应的现象就证明猜想二正确,否则猜想一正确.故答案为:②
【实验反思】根据保护环境进行思考.故答案为:净化后排放
【拓展延伸】也可从氢氧化钠角度进行鉴别.故答案为:硫酸铜溶液
点评:本题以实验探究的形式考查碱的相关的性质,既考查了对课本知识的运用能力,又培养同学们的动脑、动手的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 (2011?牡丹江)向CuSO4和H2SO4的混合溶液中,逐滴加入NaOH溶液.滴加NaOH溶液的质量与生成沉淀的质量关系如下图,结合下图回答问题:
(2011?牡丹江)向CuSO4和H2SO4的混合溶液中,逐滴加入NaOH溶液.滴加NaOH溶液的质量与生成沉淀的质量关系如下图,结合下图回答问题: