题目内容
【题目】某同学用下图所示装置研究质量守恒定律的相关问题。
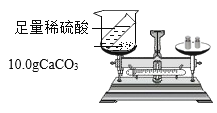
反应前称得总质量为m1,将足量稀盐酸全部倒入烧杯,充分反应后,称得总质量为m2。
(1)m1≠m2的原因是______(用化学方程式表示)。 该反应是否遵守质量守恒定律_________(填“是”或“否”)。
(2)理论上m1和m2的差值是__________ g(忽略盐酸挥发)。
【答案】CaCO3 +2 HCl= CaCl2 + H2O + CO2↑ 是 4.4
【解析】
(1)碳酸钙和稀盐酸反应生成二氧化碳、氯化钙和水,化学方程式为:CaCO3 +2HCl = CaCl2 + H2O + CO2↑,二氧化碳逸出,故总质量减少,遵循质量守恒定律;故填:CaCO3 +2HCl = CaCl2 + H2O + CO2↑;是;
(2)减少的质量(m1和m2的差)为生成的二氧化碳的质量,
设生成二氧化碳的质量为x

x=4.4g
答:生成二氧化碳的质量为4.4g。
故填:4.4。

【题目】某工厂生成了一批银戒指(银锌合金),检验部门通过化学实验来测定戒指中银的含量。先用电子秤称得戒指样品的质量是25.00克,放入烧杯中,再将稀盐酸分5次加入烧杯与样品充分反应。实验数据如下表:
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入稀盐酸的质量/克 | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
充分反应后剩余固体的质量/克 | 24.60 | 24.20 | 23.80 | 23.70 | 23.70 |
根据上表中数据分析,完成下列问题:
(1)戒指样品中银的质量是_____克。
(2)第5次实验完毕所得混合溶液中,溶质ZnCl2的质量分数是多少?(写出计算过程,结果保持两位小数)_______
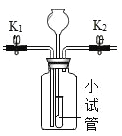
【题目】某化学兴趣小组利用下图装置进行实验。实验前K1、K2 均已关闭。
实验装置 | (实验1)制取O2 | (实验2)用NaOH溶液除去 O2中混有的CO2 |
| I. 广口瓶中放入少量MnO2 II. 打开K2,从长颈漏斗加入H2O2溶液至溢出小试管 | I. 打开K1、K2,从长颈漏斗加入足量NaOH溶液至广口瓶中液面高于左侧导管口且低于小试管口 II. …… |
(1)连接仪器后,从长颈漏斗加一定量水形成液封,发现长颈漏斗中液面比广口瓶高。一段时间后,液面高度保持不变,该现象说明______。
(2)实验1:制取O2的化学方程式是______。
(3)实验2:
①II中操作是:从______(填“左”或“右”)侧导气管通入混合气体。
②除去CO2 的反应如下,补全该反应的化学方程式:______NaOH +______CO2=______ Na2CO3+______。
【题目】兴趣小组用如图装置探究二氧化碳与氢氧化钠溶液反应。
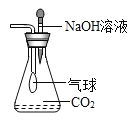
(1)写出二氧化碳与氢氧化钠反应的化学方程式:___________。实验中观 察到的现象:_________。
(2)有同学提出该方案不能说明二氧化碳与氢氧化钠发生反应,是因为:___________________。小组同学改进方案后达到了实验目的。
(3)已知15℃时,在酒精中氢氧化钠易溶,碳酸钠微溶。请结合该信息设计实验证明二氧化碳能与氢氧化钠反应,完成下表。
操作 | 现象 | 结论 |
_______________ | _______________ | 二氧化碳能与氢氧化钠反应 |
【题目】小鑫同学在实验室做制取氧气的实验,他取氯酸钾和二氧化锰的混合物 6.0 g 放入大试管中进行加热,并在不同时刻测定试管内剩余固体的质量如下表:
反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 |
剩余固体质量/g | 5.1 | 4.2 | 4.08 | 4.08 |
分析表中数据,完成下列问题:
(1)生成氧气的质量为_____g。
(2)原混合物中氯酸钾的质量是多少?_____(写出计算过程,计算结果精确到 0.1)