��Ŀ����
����Ŀ���ϳɰ��������ѧ�����ϵ�һ���ش�ͻ�ƣ�����ᷢչ��Ƽ����������˾��ס��ϳɰ����յ���Ҫ�������£�
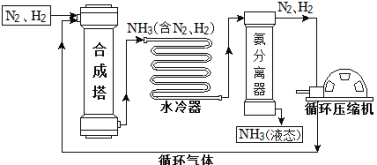
��1���ϳ����еķ�Ӧ�����ڸ��¡���ѹ�����������½��У��÷�Ӧ�����ֱ���ʽ�ǣ� ������ ���������Ӧ���ͣ���Ӧ��
��2�����������дӺϳ������������������ ����������������
��3�����������п��ظ�ʹ�õ������� ���ѧʽ����
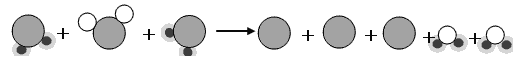
��4����ͼ�Ǻϳ����з�����Ӧ��������ʾ��ͼ��
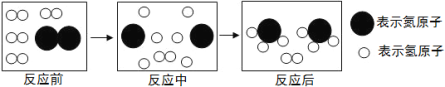
��ͼ��֪���ַ�Ӧ��N2��H2�ķ��Ӹ�����Ϊ________________��
�÷�Ӧ�е���С������ ����д��ѧ���ţ���
���𰸡���1��N2+3H2![]() 2NH3���Ϸ�Ӧ��2������3��N2��H2
2NH3���Ϸ�Ӧ��2������3��N2��H2
��4���C33.35���C252����5��1:3����ԭ�Ӻ͵�ԭ��
��������
�����������1���ݻ�ѧ����ʽ����дԭ�ɵã�N2+3H2![]() 2NH3������������������һ�����ʵĻ��Ϸ�Ӧ����2����ͼ��֪�����Ӻϳ����������ǰ����������Ļ�����3�������ظ�ʹ�õ��е�������������4���罫�������������������룬Ӧ��֤����ΪҺ�壬������������Ϊ���壬���¶�Ӧ�ÿ����ڨC33.35���C252��֮�䣻��5�����ַ�Ӧ��N2��H2�ķ��Ӹ�����Ϊ1:3����Ӧ����С��������ԭ�Ӻ͵�ԭ�ӡ�
2NH3������������������һ�����ʵĻ��Ϸ�Ӧ����2����ͼ��֪�����Ӻϳ����������ǰ����������Ļ�����3�������ظ�ʹ�õ��е�������������4���罫�������������������룬Ӧ��֤����ΪҺ�壬������������Ϊ���壬���¶�Ӧ�ÿ����ڨC33.35���C252��֮�䣻��5�����ַ�Ӧ��N2��H2�ķ��Ӹ�����Ϊ1:3����Ӧ����С��������ԭ�Ӻ͵�ԭ�ӡ�

����Ŀ��ijѧУ��ѧϰС��Ե��ص�ʯ��ʯ�������е��飬�ⶨʯ��ʯ��̼��Ƶ��������������õķ������£�ȡ��ʯ��ʯ��Ʒ20g����100gϡ������Ĵμ��룬���������������ݼ��±�����֪ʯ��ʯ��Ʒ�к��еĶ�����������ʲ�����ˮ��Ҳ����ϡ���ᷴӦ��������㣺
��� | ����ϡ���������/g | ʣ����������/g |
��һ�� | 25 | 14 |
�ڶ��� | 25 | 8 |
������ | 25 | 2.8 |
���Ĵ� | 25 | n |
��1���ϱ���n����ֵΪ ��
��2��ʯ��ʯ��Ʒ��̼��ƵĴ����Ƕ��٣�
��3����Ӧ���ɵĶ�����̼�������Ƕ��٣�