题目内容
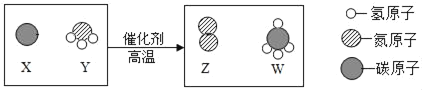
【题目】尿素[CO(NH2)2]是一种常用的化肥,工业上生产尿素的反应的微观示意图如下。下列说法中,正确的是
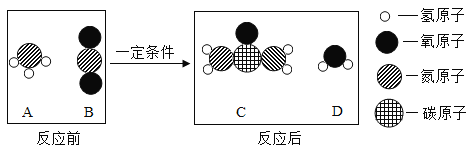
① 尿素属于氮肥 ② 尿素中C、O、N、H的原子个数比为1:1:1:2
③ 反应前后分子的个数没有改变 ④ 生产尿素的反应中,A与B的质量比为17:22
A. ①②B. ①③④C. ①②③D. ①④
【答案】D
【解析】
由图示中相关的物质的结构判断可知A为氨气(NH3)、B为二氧化碳(CO2)、C为尿素[CO(NH2)2]、D为水(H2O),其相关的方程式为:2NH3+CO2![]() CO(NH2)2+H2O。
CO(NH2)2+H2O。
①由尿素[CO(NH2)2]的化学式可知,尿素中含有农作物需要的氮元素,属于氮肥;
②由尿素的化学式可知,C、O、N、H的原子个数比为1:1:2:4;
③由微粒的变化可知,反应前后分子的个数发生了改变;
④由方程式2NH3+CO2![]() CO(NH2)2+H2O可知,生产尿素的反应中,A与B的质量比为(17×2):44=17:22;
CO(NH2)2+H2O可知,生产尿素的反应中,A与B的质量比为(17×2):44=17:22;
由以上分析可知,D正确。
故选D。

 名校课堂系列答案
名校课堂系列答案【题目】下列归纳和总结完全正确的一组是( )
A.化学反应基本类型 | B.化学反应中常见的“三” |
①化合反应:4P+5O2 ②分解反应:H2CO3═H2O+CO2↑ ③置换反应:3CO+Fe2O3 | ①煤、石油、天然气,三大化石燃料 ②可燃物、氧气、温度达到着火点,燃烧三条件 ③分子、原子、离子,构成物质的三种粒子 |
C.对鉴别方法的认识 | D.化学与生活 |
①区分氮气和氧气:伸入带火星的木条 ②区分棉纤维和羊毛纤维:点燃后闻气味 ③区分硫酸铵和氯化铵:加熟石灰粉末研磨 | ①用甲醛水溶液浸泡水产品防腐 ②缺乏维生素C易患坏血病 ③自行车支架喷油漆防锈 |
A. AB. BC. CD. D
【题目】化学与生活密切相关。周末小明和朋友带着饼干和水骑车去瘦西湖度假。
(1)如图为某饼干包装袋的部分说明。请回答下列问题:
商品名称 | ××饼干 |
配料 | 小麦粉精炼植物油鲜鸡蛋食盐膨松剂食用香精等 |
规格 | 400g |
储藏方法 | 存放于阴凉干燥处,避免阳光直射 |
保质期 | 270天 |
①在饼干的配料中,富含油脂的是_____;
②该配料中富含蛋白质的物质是_____;
③小麦粉中富含糖类,糖类在人体内经过一系列的变化最终转化为水和_____(填化学式);
④从营养均衡的角度看,该食品中除水外,还缺少的营养素是_____。
(2)单车如图所示
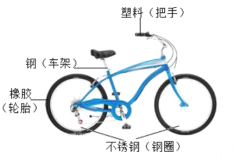
①如图所示自行车中的轮胎属于_____材料;
②防止单车的链条生锈可采取的措施是_____;
③写出用稀盐酸除去铁锈的化学方程式_____。
(3)回答与水有关的问题
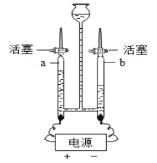
①检验某饮用水属于硬水还是软水,所用的试剂是_____;
②图装置电解水时,a管与b管产生的气体质量比为_____。
【题目】下表是 KNO3 在不同温度下的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度(g/100g 水) | 13.3 | 31.6 | 63.9 | x | 169 | 246 |
①表中“63.9”的含义是 ___。
②20℃将 31gKNO3 固体放入 50g 水中,所得溶液的质量是 ___g,若升温到 40℃所得溶液的溶质质量分数是 ___(精确到 0.1%)。
③从硝酸钾溶液中获取晶体的最佳方法是 ___。
④为测定 x 的值,取 4 份 60℃的水各 50g,分别进行实验,并记录数据如下表:
实验编号 | 甲 | 乙 | 丙 | 丁 |
KNO3 的质量/g | 40 | 50 | 60 | 70 |
H2O 质量/g | 50 | 50 | 50 | 50 |
溶液质量/g | 90 | 100 | 105 | 105 |
由实验可知 ___。
A 甲所得溶液中溶质质量分数为 80%
B 乙和丙所得溶液溶质质量分数相等
C 丙和丁所得溶液中含溶质质量相等
D 60℃时 KNO3 的溶解度为 110g/100g 水
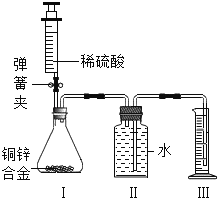
【题目】某同学对若干块矿石样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应).请计算:
序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
第1次 | 10 | 5.5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(1)8g的石灰石样品中含有杂质 克?
(2)如表中m的数值应为 ?
(3)稀盐酸的质量分数是多少?