题目内容
【题目】根据下列实验装置图,回答有关问题。
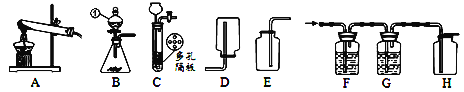
⑴仪器名称:①_______。
⑵实验室常用稀盐酸与大理石反应来制取和收集CO2,可选用的装置组合是_____(填序号),反应的化学方程式为______。C装置相对于B的优点有_____。
⑶实验制得的CO2中常含有少量H2O和HCl,通过如图(F-G)装置可获得纯净、干燥的CO2。其中F装置中放入____可除去HCl,G装置中放入___试剂可除去水蒸气。检验H装置中集气瓶里CO2已集满的方法是___。
⑷实验室里在A装置中利用KClO3和MnO2制备O2,其反应的化学方程式为___。反应后二氧化锰在固体混合物中质量分数较反应前___(填“变大”、“变小”或“不变”)。
⑸实验室用块状电石与水在常温下反应制取乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂你认为上图中最适合制取乙炔气体的发生装置是__;乙炔在空气中燃烧产生的火焰称为“氧炔焰”,可用来切割和焊接金属。故为了防止乙炔气体在点燃时发爆炸,点燃前一定要进行__操作。
【答案】分液漏斗 BE或CE CaCO3+2HCl=CaCl2+CO2↑+H2O 能使反应随时进行或停止 饱和碳酸氢钠溶液 浓硫酸 将燃着的木条放在集气瓶口处,若木条熄灭,说明CO2已集满 ![]() 变大 B 验纯
变大 B 验纯
【解析】
(1)仪器①是分液漏斗;
(2)实验室常用稀盐酸与大理石或石灰石反应来制取CO2,反应物的状态是固体和液体,不需要加热,属于固—液常温型,发生装置可选用B或C,二氧化碳密度大于空气,能溶于水,一般用向上排空气法收集,收集装置可选用E,实验室常用稀盐酸与大理石反应来制取和收集CO2,可选用的装置组合是BE或CE;大理石或石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;在装置C中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入。反应开始后,关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行,C装置相对于B的优点是能使反应随时进行或停止;
(3)碳酸氢钠溶液能与盐酸反应生成氯化钠、水和二氧化碳,所以F装置中放入饱和NaHCO3溶液可除去HCl;浓硫酸具有吸水性,G装置中放入浓硫酸可除去水蒸气。二氧化碳不能燃烧也不能支持燃烧,能使燃着的木条熄灭,检验H装置中集气瓶里CO2已集满的方法是:将燃着的木条放在集气瓶口处,若木条熄灭,说明CO2已集满;
(4)KClO3在MnO2催化作用下受热分解生成氯化钾和氧气,反应的化学方程式为:![]() ;反应前后二氧化锰质量不变,固体质量减小,因此二氧化锰在固体混合物中质量分数变大;
;反应前后二氧化锰质量不变,固体质量减小,因此二氧化锰在固体混合物中质量分数变大;
(5)实验室用块状电石与水反应制取微溶于水的乙炔气体,反应物的状态是固体和液体,不需要加热,应该用B或C装置作为发生装置,B装置中能控制加水的速率,从而可以控制反应速率,A装置不能够控制加水的速率,无法控制反应速率,因此最适合制取乙炔气体的发生装置是B装置;若可燃性气体不纯,点燃有可能发生爆炸,所以点燃可燃性气体前一定要检验其纯度。