题目内容
【题目】
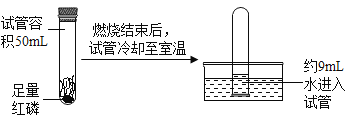
(一)实验室采用高锰酸钾制取氧气。
(1)写出制取氧气的化学方程式________;
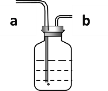
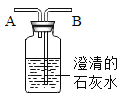
(2)如图所示,发生装置应选用________(填编号,下同),C、D、E三种收集氧气的方法中,不能采用的是_______。
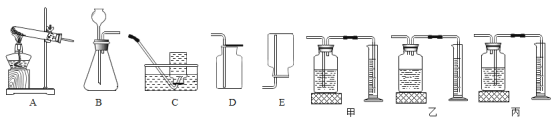
(3)为测定高锰酸钾分解生成氧气的体积,应选用如图装置__________(填编号)。
(4)实验结束后剩余的固体是________(填“纯净物”或“混合物”)。
(二)称取一定质量的铜,放入足量稀硝酸(HNO3)中,反应的化学方程式为:![]() (R表示产生气体的化学式),用排水法收集产生的气体R,生成气体R的质量与反应时间的关系如图所示,请回答下列问题:
(R表示产生气体的化学式),用排水法收集产生的气体R,生成气体R的质量与反应时间的关系如图所示,请回答下列问题:
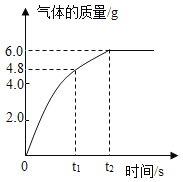
(1)气体R的化学式是________,t1时生成气体R的质量是_____g。
(2)称取铜的质量是多少?_______
【答案】 A E 丙 混合物 NO 4.8 19.2g
A E 丙 混合物 NO 4.8 19.2g
【解析】
(一)(1)高锰酸钾在加热条件下发生反应生成锰酸钾、二氧化锰、氧气,反应的化学方程式为: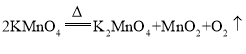
(2)加热固体制取气体选择发生装置A,故用高锰酸钾制取氧气的发生装置应选用A,氧气的密度比空气的密度大,可用向上排空气法收集,氧气不易溶于,可用排水法收集,故C、D、E三种收集氧气的方法中,不能采用的是E。
(3)为测定高锰酸钾分解生成氧气的体积,当剩余的水较少时,水易从长导气管导出,故选丙。
(4)实验结束后剩余的固体中含有锰酸钾、二氧化锰,是混合物。
(二)(1)根据化学反应前后各种原子个数相等,反应前有3Cu、8H、8N、24O,反应后(R除外)有3Cu、8H、6N、22O,故2R中含有2N、2O,气体R的化学式是NO。根据图像可知,t1时生成气体R的质量是4.8g。
(2)解:设t2时消耗铜的质量为y。
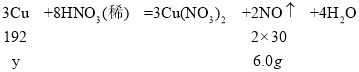
![]() ,解得y=19.2g。
,解得y=19.2g。
答:(1)气体R的化学式是NO,t1时生成气体R的质量是4.8g。
(2)称取铜的质量是多少19.2g。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案