题目内容
【题目】达州市钢铁厂用于炼铁的铁矿石主要主要成分是菱铁矿[FeCO3],课外小组同学取来该铁矿石样品12.5g,粉碎后,将125g一定溶质质量分数的稀盐酸分5次加入到该样品中,所测数据如下(杂质不与稀盐酸反应,也不溶于水):
次数 | 一 | 二 | 三 | 四 | 五 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 9.6 | 6.7 | 3.8 | 0.9 | 0.9 |
(1)第_____次恰好完全反应。
(2)该23200t这样的铁矿石理论上能冶炼得到铁的质量为_______。
(3)求加入稀盐酸恰好完全反应时所得溶液的溶质质量分数?(结果保留到0.1%)
【答案】(1)四;(2)10393.6t;(3)11.8%
【解析】(1)由表中数据可知,第四次反应后剩余固体质量不再减小,说明第四次恰好完全反应;
(2)由数据可知,铁矿石样品12.5g,中含有FeCO3的质量为12.5g-0.9g=11.6g
23200t这样的铁矿石中FeCO3的质量为![]() =21529.6t
=21529.6t
根据质量守恒定律,FeCO3中的铁将转化为铁;石理论上能冶炼得到铁的质量为21529.6t×![]() ×100%=10393.6t;
×100%=10393.6t;
(3)设生成FeCl2和CO2的质量分别为x、y,
FeCO3+2HCl=FeCl2+H2O+CO2↑,
116 127 44
11.6g x y
![]()
x=12.7g,y=4.4g,
FeCl2的质量分数为![]() ×100%=11.8%,
×100%=11.8%,
答:FeCl2的质量分数为11.8%。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】浴室喷头长时间使用会有白色固体附着,俗称水垢。这是因为硬水中含有较多的可溶性的碳酸氢钙【Ca(HCO3)2】,还含有可溶性的碳酸氢镁【Mg(HCO3)2】。查阅资料,加热时会产生难溶性的固体。其中碳酸氢钙【Ca(HCO3)2】受热易分解,生成难溶性的化合物、气体等物质。某小组想探究碳酸氢钙受热分解后产物的成分。
【提出猜想】猜想1.难溶性化合物可能是CaCO3;猜想2.气体可能是H2、CO、CO2 。
【方案设计】请你设计实验,帮助该组同学确定难溶物的成分。
实验步骤 | 实验现象 | 结论 |
_____ | _______ | 难溶物是CaCO3 |
【实验探究】该组同学设计如图实验,继续探究气体的成分。
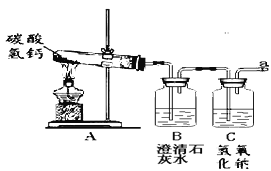
操作1.加热A装置,一段时间后,B装置中的澄清石灰水变浑浊。
操作2.在a处用燃着的木条检验,无明显现象。
【实验结论】结论1.碳酸氢钙分解产生的气体是____________;
结论2.碳酸氢钙受热分解的化学方程式为_____________________________。
【反思评价】有同学提出:硬水中可溶性的碳酸氢镁【Mg(HCO3)2】受热也会产生不溶性的固体,那水垢的成分中还有什么物质?根据上述探究,该组同学设计如下图装置进一步实验。(已知碱石灰主要成分为CaO和NaOH)
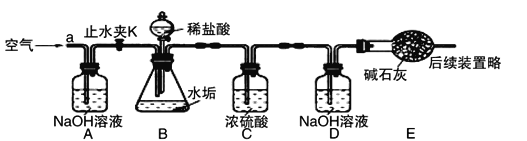
【实验测定】 步骤如下:
①按图组装仪器,先_____________,再将50g水垢样品放入锥形瓶中。
②打开止水夹K,从导管a处缓缓鼓入一定量的空气。
③逐滴加入足量稀盐酸,待锥形瓶中出现气泡不再产生现象时,停止滴加稀盐酸。
④打开止水夹K,从导管a处缓缓鼓入一定量的空气;
⑤称量D瓶内物质增加的质量,直至D瓶内物质质量不变;
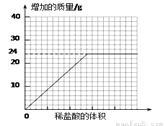
⑥测量滴加稀盐酸体积与D瓶内物质增加质量的关系如下图曲线所示。
【讨论交流】
①A装置中的NaOH溶液的作用是____________________,若没有A装置,D装置中的质量将_______________(填“偏大”、“不变”或“偏小”)。
②C装置中浓硫酸的作用是__________________,E装置的作用是____________________。
③分析曲线图,通过计算可知:水垢中一定含有(化学式)________,理由是________________。
④查阅资料:水垢的主要成分有CaCO3、MgCO3和Mg(OH)2三种成分,三种物质加热后均能生成两种氧化物。小组同学提出探究水垢中氢氧化镁的质量分数:另取质量为50g的水垢试样,放入试管中加热至质量不再减少为止,测得二氧化碳24 g,残留固体25.1g。结合以上数据,确定水垢样品中氢氧化镁的质量分数为_______________。(结果保留小数点后一位)
【题目】下列物质的归类正确的是
选项 | 甲 | 乙 |
A | 无机材料 | 陶瓷、玻璃、青铜 |
B | 同一物质 | 烧碱、纯碱、苛性钠 |
C | 提供能量营养物 | 淀粉、蛋白质、无机盐 |
D | 常见干燥剂 | 浓硫酸、生石灰、石灰石 |
A. A B. B C. C D. D


