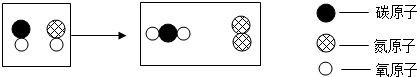
题目内容
在“宏观-微观-符号”之间建立联系,是化学学科特有的思维方式.图中 表示碳原子、
表示碳原子、 表示氧原子、
表示氧原子、 表示氢原子.
表示氢原子.
(1)水煤气是一种重要的气体燃料,以下是生产水煤气反应的微观过程示意图:

①甲、乙、丙、丁中属于氧化物的是
②甲中,氢、氧元素的质量比为
③该反应的基本反应类型为
(2)在一密闭容器内有A、B两种物质各96g组成的混合物,在一定条件下发生化学反应,反应后容器中有88g C、36g D和若干B.A、C、D三种物质的微观示意图如下表所示:
①反应后容器中剩余物质B的质量为
②已知:B的相对分子质量为28.请补全该反应的化学方程式:
 表示碳原子、
表示碳原子、 表示氧原子、
表示氧原子、 表示氢原子.
表示氢原子.(1)水煤气是一种重要的气体燃料,以下是生产水煤气反应的微观过程示意图:

①甲、乙、丙、丁中属于氧化物的是
甲丙
甲丙
(填代号).②甲中,氢、氧元素的质量比为
1:8
1:8
.③该反应的基本反应类型为
置换反应
置换反应
.(2)在一密闭容器内有A、B两种物质各96g组成的混合物,在一定条件下发生化学反应,反应后容器中有88g C、36g D和若干B.A、C、D三种物质的微观示意图如下表所示:
| 物质 | A | C | D |
| 微观示意图 |  |
 |
 |
68
68
g.②已知:B的相对分子质量为28.请补全该反应的化学方程式:
3
3
O2+C2H4
C2H4
═2CO2+2H2O.分析:(1)依据水煤气的制取图示书写该过程的反应方程式,据此分析解答问题即可;
(2)(2)①根据质量守恒定律反应前后原子的种类及数目不变分析;
②根据反应的微观示意图中微粒的变化分析化学变化的实质;
(3)①根据质量守恒定律,由物质质量的增减量可确定反应物和生成物的质量,从而得出X的值;
②根据物质中元素的质量可确定构成物质的原子个数比,从而得到物质的化学式,根据化学方程式的书写步骤可写出该反应的化学方程式
(2)(2)①根据质量守恒定律反应前后原子的种类及数目不变分析;
②根据反应的微观示意图中微粒的变化分析化学变化的实质;
(3)①根据质量守恒定律,由物质质量的增减量可确定反应物和生成物的质量,从而得出X的值;
②根据物质中元素的质量可确定构成物质的原子个数比,从而得到物质的化学式,根据化学方程式的书写步骤可写出该反应的化学方程式
解答:解:(1)由图示可以看出该反应的反应物是水和碳,生成物是一氧化碳和氢气,反应的方程式为H2O+C
CO+H2;
①氧化物是含有两种元素且其中一种是氧元素的纯净物,故甲、乙、丙、丁中属于氧化物的是甲和丙;
②甲的化学式为H2O,其中氢和氧元素的质量比是1×2:16=1:8;
③该反应的反应物生成物均是一种单质和一种化合物,故该反应是置换反应;
(2)①由题目的叙述可知该反应中生成物CD的质量之和是88g+36g=124g大于96g,故B是反应物,依据质量守恒定律可知参加反应的B的质量是124g-96g=28g,故容器内剩余的B的质量是96g-28g=68g;
②根据该反应的方程式情况可知反应物B一定含有碳氢两种元素,可能含有氧元素,B的相对分子质量为28,所以可知该物质中只含有碳氢两种元素,故设该物质的化学式为CxHy;由于反应前后各种原子的个数均相等,所以氧气前的化学计量数为3;由于反应后生成物中的碳氢两种元素均来自于CxHy,所以该物质中碳元素的质量为88g×
=24g,氢元素的质量为36g×
=4g,则有
CxHy中碳氢元素的质量之比为
=
则
=
,故化学式为C2H4;该物质的相对分子质量为28,故推断合理,所以该反应的方程式为:3O2+C2H4═2CO2+2H2O.
故答案为:(1)①甲、丙;②1:8;③置换反应;(2)①68;②3;C2H4;
| ||
①氧化物是含有两种元素且其中一种是氧元素的纯净物,故甲、乙、丙、丁中属于氧化物的是甲和丙;
②甲的化学式为H2O,其中氢和氧元素的质量比是1×2:16=1:8;
③该反应的反应物生成物均是一种单质和一种化合物,故该反应是置换反应;
(2)①由题目的叙述可知该反应中生成物CD的质量之和是88g+36g=124g大于96g,故B是反应物,依据质量守恒定律可知参加反应的B的质量是124g-96g=28g,故容器内剩余的B的质量是96g-28g=68g;
②根据该反应的方程式情况可知反应物B一定含有碳氢两种元素,可能含有氧元素,B的相对分子质量为28,所以可知该物质中只含有碳氢两种元素,故设该物质的化学式为CxHy;由于反应前后各种原子的个数均相等,所以氧气前的化学计量数为3;由于反应后生成物中的碳氢两种元素均来自于CxHy,所以该物质中碳元素的质量为88g×
| 12 |
| 44 |
| 2 |
| 18 |
CxHy中碳氢元素的质量之比为
| 12x |
| y |
| 24g |
| 4g |
| x |
| y |
| 2 |
| 4 |
故答案为:(1)①甲、丙;②1:8;③置换反应;(2)①68;②3;C2H4;
点评:此题是有关质量守恒定律的考查,解题的关键是理解该定律的宏观及微观含义,是一道考查较为全面的有关质量守恒定律的好题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ”表示氯原子,用
”表示氯原子,用 ”表示氯气分子,如图1为A、B两种物质反应的微观过程(恰好完全反应),请你根据图示回答下列问题:
”表示氯气分子,如图1为A、B两种物质反应的微观过程(恰好完全反应),请你根据图示回答下列问题: