题目内容
【题目】化学兴趣小组的同学取10 g某锌样品(含少量杂质,且杂质不溶于水,也不与酸反应)于烧杯中,向其中加入一定量的稀硫酸,当加入稀硫酸的质量为93.7 g时,恰好完全反应,生成气体的质量与反应时间的关系如下图所示,试回答下列问题:

(提示:Zn+H2SO4=ZnSO4+H2↑)
(1)从图中可以看出,完全反应后生成氢气的质量为 g。
(2)样品中锌的质量为 g。
(3)反应后,所得溶液中硫酸锌的质量分数为多少?
【答案】(1)0.2 (2)6.5 (3)16.1%
【解析】
试题分析:(1)根据图示,完全反应后生成氢气的质量为0.2 g
(2)根据化学反应方程式:Zn+H2SO4=ZnSO4+H2↑中Zn与H2的质量关系=65:2,故要生成0.2 g 氢气,需要锌的质量为6.5g
(3)根据化学反应方程式:Zn+H2SO4=ZnSO4+H2↑中ZnSO4与H2的质量关系,即可求出溶质ZnSO4的质量,进而可计算所得溶液中硫酸锌的质量分数
解:设生成硫酸锌的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
161 2
x 0.2g
161:2=x:0.2g
X=16.1g
反应后溶液的质量=6.5g+93.7g-0.2g=100g
所得溶液中,硫酸锌的质量分数=16.1g/100g×100%=16.1%
答:所用稀硫酸中溶质的质量分数为16.1%

 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】(7分)如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂。甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。
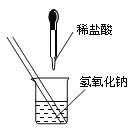
(1)请写出该中和反应方程式: 。
猜想与假设:
【猜想一】甲同学:“两种物质已恰好完全中和,溶液呈中性”;
【猜想二】乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
【猜想三】丙同学: 。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是: 。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH_______(填“>”、“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
猜想三: ______________ (填“成立”或“不成立”) |