题目内容
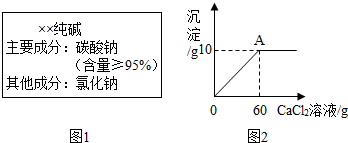
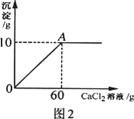
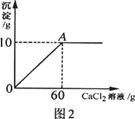
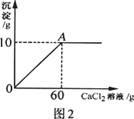
小雨从超市买同一包纯碱,其包装说明如图1所示.他称取了11g纯碱样品溶于水中配制成50g溶液,然后向溶液中滴加氯化钙溶液,其产生沉淀的质量与滴加氯化钙溶液的质量关系如图2所示.
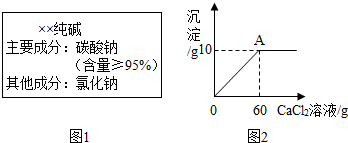
(1)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符.
(2)计算A点时,所用溶液中溶质的质量分数.(计算结果保留一位小数)
解:设样品中碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 10g y

解得:x=10.6g y=11.7g
(1)样品中碳酸钠的质量分数为: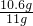 ×100%=96.4%>95%;
×100%=96.4%>95%;
所以纯碱样品中碳酸钠的质量分数与包装说明相符.
(2)A点时,所得溶液中溶质的质量为:11.7g+(11g-10.6g)=12.1g;
A点时,所得溶液中溶液的质量为:50g+60g-l0g=100g;
A点时,所得溶液中溶液的质量分数为: ×100%=12.1%;
×100%=12.1%;
答:(1)纯碱样品中碳酸钠的质量分数与包装说明相符;
(2)纯碱样品中碳酸钠的质量分数与包装说明相符12.1%.
故答案为:(1)纯碱样品中碳酸钠的质量分数与包装说明相符;
(2)12.1%.
分析:根据题意可知本题中所发生的反应为碳酸钠和氯化钙的反应,其反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl,分析题给的图象可以知道生成碳酸钙沉淀的质量为10g,可以据此进行计算,解答时要注意求算反应后溶质的质量要考虑到纯碱样品中的氯化钠.
点评:本题主要考查学生对溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 10g y

解得:x=10.6g y=11.7g
(1)样品中碳酸钠的质量分数为:
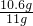 ×100%=96.4%>95%;
×100%=96.4%>95%;所以纯碱样品中碳酸钠的质量分数与包装说明相符.
(2)A点时,所得溶液中溶质的质量为:11.7g+(11g-10.6g)=12.1g;
A点时,所得溶液中溶液的质量为:50g+60g-l0g=100g;
A点时,所得溶液中溶液的质量分数为:
 ×100%=12.1%;
×100%=12.1%;答:(1)纯碱样品中碳酸钠的质量分数与包装说明相符;
(2)纯碱样品中碳酸钠的质量分数与包装说明相符12.1%.
故答案为:(1)纯碱样品中碳酸钠的质量分数与包装说明相符;
(2)12.1%.
分析:根据题意可知本题中所发生的反应为碳酸钠和氯化钙的反应,其反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl,分析题给的图象可以知道生成碳酸钙沉淀的质量为10g,可以据此进行计算,解答时要注意求算反应后溶质的质量要考虑到纯碱样品中的氯化钠.
点评:本题主要考查学生对溶质质量分数的计算能力.学生需正确书写出化学方程式,然后根据化学方程式找出比例关系,列出比例式,并正确分析各物质之间的关系,才能正确答题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目