��Ŀ����
����Ŀ�������к�����ɳ������������MgCl2��CaC12��Na2SO4�����ʡ�
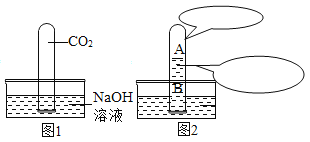
(1)ȥ�������е���ɳ����ȡ������Ʒ10.0g��������ˮ����ܽ⣬����ȥ����ɳ�õ���ҺA���������õIJ��������У��ձ���©����_____��
(2)ȥ�����������ʡ�����ҺA����ͼ����ͼ���д�����
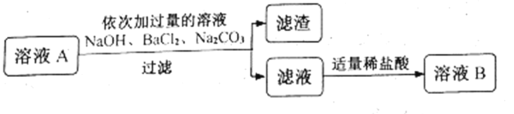
�ټ���������NaOH��Һʱ����������Ӧ�Ļ�ѧ����ʽ��______��
�ڹ��˺����õ������ɷ���______�֡�
���ж���ϡ�����������ķ����ǣ�������μ�����_____��
(3)��ò�Ʒ������ҺB����____(����������)�У����ȣ����������г���____����ʱ��ֹͣ���ȣ���������ʹ��Һ���ɡ�
���𰸡������� 2NaOH+MgCl2=Mg(OH)2��+2NaCl 4 �պò��ٲ������� ������ �϶�
��������
��1���ڴ����ܽ⡢���˹����У����ձ���©���⣬��ʹ�õIJ������������в�������������������ܽ⡣��������������
��2���ټ��롰����NaOH��Һʱ�����Ȼ�þ���������Ʒ�Ӧ����������þ�������Ȼ��ƣ������ķ�Ӧ����ʽΪ2NaOH+MgCl2=Mg(OH)2��+2NaCl��
�ڹ��˺����õ������ɷ���4�֣����������ƺ��Ȼ�þ���ɵ�������þ���Ȼ��������ᷴӦ���ɵ����ᱵ��̼���ƺ��Ȼ������ɵ�̼��ơ�̼���ƺ������Ȼ������ɵ�̼�ᱵ������4����
����Һ�е��������Ȼ��ơ��������ơ�̼���ƣ���������ʱ�����������������Ʒ�Ӧ������̼���Ʒ�Ӧ���ɶ�����̼���������ݣ��ж���ϡ�����������ķ����ǣ�������μ������պò��ٲ������ݡ�
��3�������ᾧʱ������Һע���������У������ᾧ���۲쵽�н϶ྦྷ������ʱ��ֹͣ���ȣ���������ʹ��Һ���ɡ���������϶ࡱ��

 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
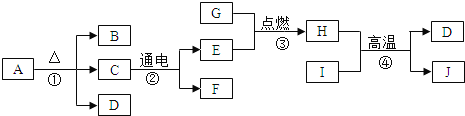
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�����Ŀ��ijͬѧ������ͼ����ʵ�顣
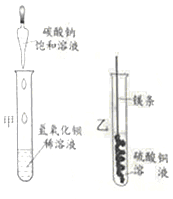
��l����ʵ���з�Ӧ�Ļ�ѧ����ʽΪ____________��
��2����ʵ��۲쵽��������___________����Һ����ɫ�����ɫ��
��3���Ѽס��ҷ�Ӧ�����Һ����ͬһ�ջ��������а�ɫ�������ɡ���������ɫ�����ijɷֽ���̽����
���������ϡ����ᱵ�������ᡣ
��������롿 ��ɫ����Ϊ����._______����.Mg(OH)2��BaSO4������Mg(OH)2��MgCO3.
��ʵ�鷽����
ʵ����� | ʵ����������� |
���ˡ�ϴ�Ӱ�ɫ�������ã����ɫ�����м������������� | ��������ȫ���ܽ⣬�����������������������仯ѧ��Ӧ����ʽΪ____________�� ����______������������������������� ����������ȫ�ܽ⣬________�������������� |
����չ��˼������������������������˽����ԭ��������ʵ��ʱ___________��������ɫ�����ijɷֲ����ܳ��ֵ������Mg(OH)2��MgCO3��BaSO4��ԭ����__________________��
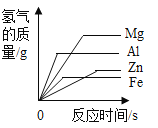
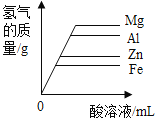
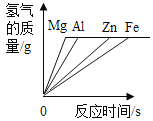
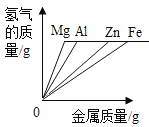
����Ŀ��þ������п������ϡ�����ϡ����֮��ķ�Ӧ���ɼ�ͼ����ȷ����(����)
|
|
|
|
A��������þ������п�����������ᷴӦ�����������뷴Ӧʱ��Ĺ�ϵͼ�� | B��������þ������п�����������ᷴӦ����������������Һ�Ĺ�ϵͼ�� | C������������þ������п������Ӧ�����������뷴Ӧʱ��Ĺ�ϵͼ�� | D������������þ������п������Ӧ��������������������Ĺ�ϵͼ�� |
A.AB.BC.CD.D