题目内容
(2013?海门市二模)比较与分析归纳是学习化学的常用方法.请比较表中信息,回答有关问题:
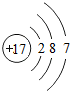
(1)氟单质的状态
(2)氟原子容易得到电子,形成的离子与Ca2+形成化合物的化学式为
(3)试归纳氟、氯、溴、碘的原子结构规律(答一点即可):
(4)HBr的化学性质与HCl相似,试写出HBr与NaOH溶液反应的化学方程式:
| 元素名称 | 氟 | 氯 | 溴 | 碘 |
| 元素符号 | F | Cl | Br | I |
| 原子结构 示意图 |
 |
 |
 |
 |
| 单质化学式 | F2 | Cl2 | Br2 | I2 I2 |
| 常温常压下 | 气态 气态 |
气态 | 液态 | 固态 |
气态
气态
;溴原子结构中的X=35
35
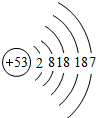
;碘单质的化学式I2
I2
;(2)氟原子容易得到电子,形成的离子与Ca2+形成化合物的化学式为
CaF2
CaF2
;(3)试归纳氟、氯、溴、碘的原子结构规律(答一点即可):
从氟原子到碘原子的变化规律是电子层数依次增加一层
从氟原子到碘原子的变化规律是电子层数依次增加一层
;(4)HBr的化学性质与HCl相似,试写出HBr与NaOH溶液反应的化学方程式:
HBr+NaOH=NaBr+H2O
HBr+NaOH=NaBr+H2O
.分析:(1)依据氯族元素的单质的状态,以及原子中质子数等于核外电子数和碘单质的化学式分析解答;
(2)依据钙离子和氟离子的带电荷情况书写化学式;
(3)根据四种元素的核外电子排布情况分析解答;
(4)依据盐酸与氢氧化钠的反应方程式用类比的方法书写化学式即可;
(2)依据钙离子和氟离子的带电荷情况书写化学式;
(3)根据四种元素的核外电子排布情况分析解答;
(4)依据盐酸与氢氧化钠的反应方程式用类比的方法书写化学式即可;
解答:解:(1)氟单质的状态一般为气态,根据原子中质子数等于核外电子数,所以可知X=2+8+18+7=35,碘单质的化学式为I2;
(2)氟原子在化学反应中容易得到1个电子,所以化合价一般为-1价,钙元素一般显+2价,所以两者形成的化合物的化学式为CaF2;
(3)根据氟、氯、溴、碘的原子结构可知从氟到碘的变化规律是电子层数依次增加一层;
(4)盐酸和氢氧化钠的反应方程式为HCl+NaOH=NaCl+H2O,由于HBr的化学性质与HCl相似,故HBr与NaOH溶液反应的化学方程式为HBr+NaOH=NaBr+H2O;
故答案为:(1)气态;35;I2;(2)CaF2;(3)从氟原子到碘原子的变化规律是电子层数依次增加一层;(4)HBr+NaOH=NaBr+H2O;
(2)氟原子在化学反应中容易得到1个电子,所以化合价一般为-1价,钙元素一般显+2价,所以两者形成的化合物的化学式为CaF2;
(3)根据氟、氯、溴、碘的原子结构可知从氟到碘的变化规律是电子层数依次增加一层;
(4)盐酸和氢氧化钠的反应方程式为HCl+NaOH=NaCl+H2O,由于HBr的化学性质与HCl相似,故HBr与NaOH溶液反应的化学方程式为HBr+NaOH=NaBr+H2O;
故答案为:(1)气态;35;I2;(2)CaF2;(3)从氟原子到碘原子的变化规律是电子层数依次增加一层;(4)HBr+NaOH=NaBr+H2O;
点评:此题是对氯族元素有关知识的考查,解题的关键是对有关的氯族元素规律的掌握;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2013?海门市二模)如图是实验室制取气体的部分装置,下列说法不正确的是( )
(2013?海门市二模)如图是实验室制取气体的部分装置,下列说法不正确的是( )
 (2013?海门市二模) 关注碳排放.
(2013?海门市二模) 关注碳排放.