题目内容
【题目】某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如下: 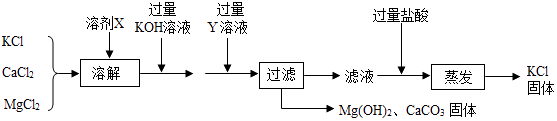
请认真分析流程中各步骤的信息作答:
(1)溶剂X是;Y溶液中溶质的化学式为: .
(2)蒸发操作的目的是除去(填物质的化学式) .
(3)写出加入过量KOH溶液反应的化学方程式: .
(4)另有A,B,C三瓶失去标签的无色溶液,它们分别是盐酸、澄清石灰水和碳酸钠溶液中的一种.为了鉴别它们,各取少量溶液两两混合,实验结果如下表所示.表中“↓”表示有沉淀产生;“↑”表示有气体产生;“﹣”表示观察不到明显的现象变化.
A | B | C | |
A | ↑ | ﹣ | |
B | ↑ | ↓ | |
C | ﹣ | ↓ |
回答下列问题:
①A中溶质的化学式是 , A与C反应的基本类型是;
②A与B、B与C反应的化学方程式分别是、 .
【答案】
(1)水(或H2O);K2CO3
(2)H2O、HCl(不得有缺)
(3)MgCl2+2KOH=Mg(OH)2↓+2KCl;
(4)HCl;复分解反应;2HCl+Na2CO3═2NaCl+CO2↑+H2O;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
【解析】解:(1)要除去氯化钾样品中的氯化钙和氯化镁,实质就是除去钙离子和镁离子,可采用加水溶解后,利用过量氢氧化钾溶液与氯化镁反应生成氢氧化镁沉淀和氯化钾,过量碳酸钾溶液与氯化钙反应生成碳酸钙沉淀和氯化钾溶液,然后过滤,向滤液中加入过量的稀盐酸,除去过量的碳酸钾溶液和氢氧化钾溶液,再蒸发除去过量的稀盐酸,能除去杂质且没有引入新的杂质,符合除杂原则.溶剂X是水,Y溶液中溶质的化学式为K2CO3.(2)蒸发操作的目的是除去稀盐酸和水,其化学式分别为:HCl、H2O.(3)过量氢氧化钾溶液与氯化镁反应生成氢氧化镁沉淀和氯化钾,反应的化学方程式为:MgCl2+2KOH=Mg(OH)2↓+2KCl.①盐酸会与碳酸钠反应生成二氧化碳气体,盐酸和氢氧化钙反应没有明显现象,澄清石灰水会与碳酸钠反应生成碳酸钙沉淀.
B和A会生成气体,B和C会生成沉淀,所以B是碳酸钠,A是HCl,C是氢氧化钙,A与C的反应是盐酸和氢氧化钙反应生成氯化钙和水,所以基本反应类型是复分解反应;②A与B的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
B与C的反应是碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.所以答案是:(1)水(或H2O);K2CO3;(2)H2O、HCl(不得有缺);(3)MgCl2+2KOH=Mg(OH)2↓+2KCl;①HCl 复分解反应 ②2HCl+Na2CO3═2NaCl+CO2↑+H2O Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
【考点精析】本题主要考查了混合物的分离方法和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握混合物的分离:1、过滤法:分离可溶物 + 难溶物2、结晶法:分离几种可溶性物质;注意:a、配平 b、条件 c、箭号才能正确解答此题.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案