��Ŀ����
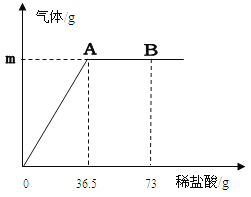
����Ŀ����6�֣���ȡNaCl��BaCl2�Ĺ�������32.5g������100g����ˮ����ȫ�ܽ����û����Һ����μ�����������Ϊ10%��Na2SO4��Һ����Ӧ����BaSO4�������������������Na2SO4��Һ��������ϵ��ͼ��ʾ���Իش��������⣺
��1����ȫ��Ӧ������BaSO4������ ��g��
��2��ǡ����ȫ��Ӧʱ����Na2SO4��Һ�������Ƕ��ٿˣ�
��3��ǡ����ȫ��Ӧʱ������Һ�����ʵ����������Ƕ��٣�
���𰸡���1��23.3�� (2) 142g (3) 9.3%
��������
�������������ͼʾ��֪���ɳ��������������������Ȼ�����Ӧ��������ᱵ���������ݳ��������������û�ѧ����ʽ���ᱵ�������Ƶ������ȿ���������Ƶ�������
��BaCl2������Ϊx����Ӧ���ɵ�NaCl������Ϊy��ǡ����ȫ��Ӧʱ����Na2SO4������Ϊz
BaCl2+Na2SO4�TBaSO4��+2NaCl
208 142 233 117
x z 23.3g y
![]() =
=![]()
x=20.8g
y=11.7g
z=14.2g
��2��ǡ����ȫ��Ӧʱ����Na2SO4��Һ������Ϊ��14.2g��10%=142g
��3��ǡ����ȫ��Ӧʱ����Һ��NaCl������Ϊ��11.7g+��32.5g��20.8g��=23.4g
ǡ����ȫ��Ӧʱ����NaCl ��Һ���ʵ���������![]() ��100%=9.3%
��100%=9.3%
��ǡ����ȫ��Ӧʱ����NaCl ��Һ���ʵ���������Ϊ9.3%

����Ŀ����7�֣����죬С��������ȥҽԺ���Σ����ֻ�ʿ����Һ���Ϸ���һ��ֽ������ͼ��ʾ������ѯ�ʵ�֪��������ů���������е�Һ�塣С������Ķ����ܲ��������е������棬���ǣ�����ʿҪ��һֻ�ù���ֽ��������������������̽����
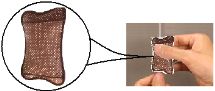
̽��һ��������ʲô���ʡ�
������ֽ��������������һЩ��ɫ��ĩ�Ͱ���ɫ��ĩ��
��������롿ֽ��������ʿ�����̿�ۡ����ۡ�������������������ij�������ʵĻ���
���������ϡ�����������һ�ֺ�ɫ��ĩ��������ˮ���ڿ����������ȼ���Ѹ��������������������������������ֻ�������������ܱ��������������������������ᷴӦ�����Ȼ��������Ȼ�����ˮ��
���������ۡ���������֪ʶ������Ϊֽ���еĺ�ɫ��ĩ���˲����������⣬�����ܺ��� ��
������ʵ�顿
ʵ���� | ʵ����� | ʵ������ |
�� | ������������ĩ | ��ɫ��ĩ���ֱ�����������ɫ��ĩ�������� |
�� | ȡ������ĩ��������ϡ���� | �����ݲ������ײ��к�ɫ������ |
���ó����ۡ����÷�ĩ��һ������ ��
��ʵ�����в������ݵĻ�ѧ����ʽ��__________________________________________��
̽������ֽ��Ϊʲô����ȡ�
���������ϡ������ڿ����лᷢ�������������ų�������ת������������
����д���÷�Ӧ�Ļ�ѧ����ʽ ��
��������ȷ��������������ݽ�����4�֡�����ѧ�Ծ��ֲܷ�����60�֡�
�������ʵ���л����ܵó�ֽ����һ��������������������������������ʵ�����ݣ�
ʵ�鲽�� | ʵ������ | ���� |
ֽ���к��������������� |