题目内容
18、某同学通过实验比较四种金属的活泼性大小.他取等质量的金属粉末分别与等质量分数的足量稀盐酸反应将实验的结果记录在下表,由此得出的实验结论正确的是( )
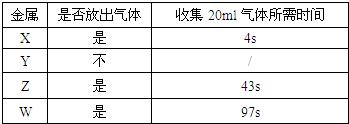

分析:金属的活动性强弱的检验,在实验时排在氢元素前面的金属能根据与酸的反应的快慢来确定活动性强弱.也可用金属与盐溶液反应,来确定金属的活动性强弱.
解答:解:A、能与酸反应的金属一定是在金属活动顺序表里排在氢元素前面的金属,不能与酸反应的金属一定是在金属活动顺序表里排在氢元素后面的金属;因金属Y不能生成氢气故四种金属中Y最弱,故错
B、不同的活泼金属与酸反应时,活动性强的金属相同质量时与酸完全反应,所需的时间短,所以根据所用时间的长短可判断金属的活动性强弱.故对
C、因盐酸具有挥发性,制取的氢气中会混有氯化氢气体;故错D、因Y不能产生氢气;故错
故选B
B、不同的活泼金属与酸反应时,活动性强的金属相同质量时与酸完全反应,所需的时间短,所以根据所用时间的长短可判断金属的活动性强弱.故对
C、因盐酸具有挥发性,制取的氢气中会混有氯化氢气体;故错D、因Y不能产生氢气;故错
故选B
点评:金属的活动性强弱的检验,可根据与酸的反应产生氢气的快慢来确定;氢气质量的多少,若活泼金属都是正二价时,相同质量完全反应时,产生的氢气质量的多少,跟金属的相对原子质量有关,相对原子质量越小,产生的氢气质量越多.答

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
23、某同学通过实验比较四种金属的活动性大小.他取等质量的金属粉末分别与足量的等质量分数的稀盐酸反应,实验结果记录在下表.由此得出的实验结论正确的是( )
|
(2006?自贡)某同学通过实验比较四种金属的活泼性大小.他取等质量的金属,使之分别与等质量分数的足量稀硫酸反应,其实验结果记录在下表中,据此得出这四种金属的活动性顺序为( )
|