题目内容
【题目】下表是NaCl、KClO3在不同温度下的溶解度(单位:g/100g水)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
S(NaCl) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
S(KClO3) | 3.3 | 7.3 | 13.9 | 23.8 | 37.5 | 56.3 |
① 20℃时,NaCl的溶解度为 g/100g水;
②40℃时,将10gKClO3放入100g水中充分溶解,所得溶液溶质质量分数为(最简分数);
③ “海水晒盐”利用的方法是(填“蒸发结晶”或“降温结晶”);
④ 工业上用氯化钠溶液制备氯酸钾,主要流程如下: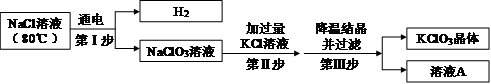
(第Ⅱ步中发生的反应:NaClO3+KCl→NaCl+KClO3)
上述流程中,氯化钠溶液中的水是否参与第Ⅰ步化学反应?(填“是”或“否”)。
溶液A中的溶质除NaCl外,还含有(填化学式)。
【答案】36.0;![]() ;蒸发结晶;是;KCl、KClO3
;蒸发结晶;是;KCl、KClO3
【解析】①溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。由题中信息可知20℃时,NaCl的溶解度为36.0 g/100g水;
②40℃时,硝酸钾的溶解度为13.9g,将10gKClO3放入100g水中能完全溶解,所得溶液溶质质量分数为10g ÷(10g+100g)×100%=![]() ;
;
③氯化钠的溶解度受温度的影响比较小,所以应该用蒸发结晶的方法式食盐从溶液中分离出来;
④氯化钠和水 在通电条件下生成氢氧化钠、氯气、氢气;因步骤Ⅱ中加入过量的氯化钾,所以溶液A中有氯化钠、KCl、KClO3.
故答案为:36.0;![]() ;蒸发结晶;是;KCl、KClO3.
;蒸发结晶;是;KCl、KClO3.
①由表可知20℃时NaCl的溶解度;
②找出40℃时KClO3的溶解度,并判断0gKClO3是否能全部溶于100g水中,最后根据溶质的质量分数等于溶质的质量除以溶液的质量解答即可;
③溶解度随温度变化不大的物体,可以使用蒸发结晶的方法获得晶体;
④根据质量守恒以及降温结晶的特点分析.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案