题目内容
下列算式或计算结果正确的是( )
| A、CO中碳和氧的质量比为1:1 | ||
| B、NH3的式量为14+1×3=17 | ||
| C、“3SO2”的相对分子质量总和与“2SO3”的相对分子质量总和相等 | ||
D、NaNO3中氮的百分含量为:
|
分析:A、根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答;
B、根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行解答;
C、分别求出3SO2”的相对分子质量与“2SO3”的相对分子质量进行比较即可;
D、根据物质中某元素的质量分数=
×100%.进行解答.
B、根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行解答;
C、分别求出3SO2”的相对分子质量与“2SO3”的相对分子质量进行比较即可;
D、根据物质中某元素的质量分数=
| 该元素的相对原子质量 × 原子个数 |
| 化合物的相对分子质量 |
解答:解:A、根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得CO中碳和氧的质量比为:12:16=3:4;故A错误;
B、根据相对分子的质量为组成分子的各原子的相对原子质量之和,NH3的式量为14+1×3=17;故B正确;
C、3SO2的相对分子质量为:3×(32+16×2)=192;2SO3的相对分子质量为:2×(32+16×3)=160;故C错误;
D、根据物质中某元素的质量分数=
×100%.因此NaNO3中氮的百分含量=
×100%,故D错误;
故选B.
B、根据相对分子的质量为组成分子的各原子的相对原子质量之和,NH3的式量为14+1×3=17;故B正确;
C、3SO2的相对分子质量为:3×(32+16×2)=192;2SO3的相对分子质量为:2×(32+16×3)=160;故C错误;
D、根据物质中某元素的质量分数=
| 该元素的相对原子质量 × 原子个数 |
| 化合物的相对分子质量 |
| N |
| NaNO3 |
故选B.
点评:本题考查学生对化合物中各元素质量比,物质中某元素的质量分数,相对分子的质量的知识理解与掌握,并能在解题中灵活应用.

练习册系列答案
相关题目
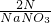 ×100%
×100%