题目内容
【题目】(6分)工业上生产电路板及处理废液的工艺流程如下:
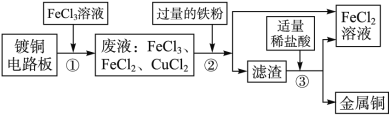
(1)由步骤①可判断FeCl3与铜反应生成的两种产物是________和________。
(2)步骤②加入过量的铁粉,除能与废液中FeCl3反应外,还可发生的化学反应方程式为____________________________________________________________。
(3)步骤③加入稀盐酸,充分搅拌,当观察到________________________时,说明滤渣只剩铜。
(4)步骤②③所得FeCl2可与一种单质发生化合反应生成FeCl3,实现循环使用。根据质量守恒定律可推测该单质的化学式为___________。
【答案】(1)FeCl2 CuCl2 (或CuCl2 FeCl2) (2)Fe+CuCl2===FeCl2+Cu
(3)不再有气泡产生 (4)Cl2
【解析】
试题分析:(1)由反应的流程可知FeCl3与铜反应生成的两种产物是氯化亚铁和氯化铜;
(2)在金属活动性顺序中,铁位于铜的前面故能把硫酸铜中的铜置换出来:Fe+CuCl2===FeCl2+Cu;
(3)铁能与稀盐酸反应生成氢气,故只有铜,那么不会有气泡产生;
(4)依据质量守恒定律化学反应前后元素的质量不变,由于反应物是氯化亚铁和一种单质,生成物是氯化铁,故反应物是氯气。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目