��Ŀ����
����Ŀ��С��ͬѧ����п�����ᷴӦ������Ӱ��������������̽����
��������⡿п�����ᷴӦ�Ŀ�������Щ���ص�Ӱ���أ�
����������衿
a.��������������������йأ�
b.������п����״�йء�
���������ϡ�
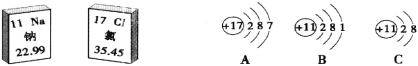
п�Ļ�ѧ���ʱȽϻ��ã��ڳ����µĿ����У���������һ��������Ĥ��������ֹ��һ����������������Ĥ�����Ժ��ᷴӦ����������������
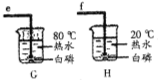
����Ʋ�ʵ�顿С���ò�ͬ��������������Ͳ�ͬ��״��п��������ʵ�顣
ʵ���� | �����������������ȡ20mL�� | п����״����ȡ1g�� | ���������(mL)�����ռ�3���ӣ� |
�� | 20% | � | 31.7 |
�� | 20% | пƬ | 50.9 |
�� | 20% | � | 61.7 |
�� | 30% | пƬ | 79.9 |
��1��д��ϡ������п��Ӧ�Ļ�ѧ����ʽ______________________________��
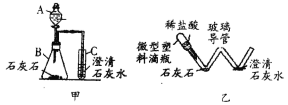
��2��С����ͼװ���ռ������������������������Ͳ��������_______________________������Ӧ��________����e��f��g����ͨ�룻

���ռ�֤�ݡ�
��3��Ҫ�Ƚϲ�ͬ��������������Է�Ӧ������Ӱ�죬Ӧѡ���ʵ������____________��
���ó����ۡ�
��4��������_____________________________________________________��
�������뷴˼��
��5���±���С��������ʵ�����ϸ���ݡ�
ʱ�Σ���Ϊ1���ӣ� | ��1���� | ��2���� | ��3���� | ��4���� | ��5���� | ��6���� |
H2����� | 3.1mL | 16.7mL | 11. 9mL | 9.6mL | 7.6mL | 6.0mL |
������п�����ᷴӦ�������������ֱ�����ԭ��___________________________��
��6������Ϊп�����ᷴӦ�Ŀ������ܻ��� ����Ӱ�죿
��7��ȡij��������������Ʒ6g����100g������ϡ�����ַ�Ӧ�Ƶ�ʣ�����ʵ�������Ϊ105.8g��
���������������Ϊ �ˣ�
���ó�������������Ʒ���������������Ƕ��٣���д������Ĺ��̣������ȷ��0.1%��
���ó������������Ƿ�ϸ� �������ϸ����������ϸ�����
���𰸡���1��Zn+H2SO4==ZnSO4+H2��
��2�������ų�ˮ���������Ϊ����������� f
��3���٢����ڢ�
��4������ԽŨ����ӦԽ�죻��пƬ��п����Ӧ�죩���������ɣ�
��5����ʼ����Ϊ������Ĥ������п�ı��棬Ȼ����죬���ŷ�Ӧ�Ľ������������������С����Ӧ�����ֱ��������������ɣ�
��6���¶�
��7����0.2�ˣ� 93.3% �����ϸ�
��������
�����������1��ϡ������п��Ӧ��������п���������ʷ�Ӧ�ķ���ʽΪ��Zn+H2SO4=ZnSO4+H2����
��2����Ϊ������������ˮ������ͨ��ѹǿ�ı仯������ˮ����ˮѹ����Ͳ�ڣ����ݽ�����Ͳ��ˮ��������ж�����������������ʽ������Ƕ̹�f���ʴ�Ϊ�������ų�ˮ���������Ϊ�����������f��
��3����ΪҪ�Ƚϲ�ͬ��������������Է�Ӧ������Ӱ�죬���������������ӦΪ���������������䡣����Ӧѡ����������������ͬ��п״̬��ͬ��������жԱȣ���˿���ѡ���٢�������п�������ڢ�������пƬ����
��4��ͨ���٢�������п�������������������ͬ�������Կ������������������Խ��Ӧ����Խ�죻ͨ���٢���п����пƬ������������ͬ�����ᷴӦ�����Կ�����п������ĽӴ����Խ��Ӧ����Խ�죻
��5����ʼ����Ϊ������Ĥ������п�ı��棬Ȼ����죬���ŷ�Ӧ�Ľ������������������С����Ӧ�����ֱ�����
(6)����Ӱ�췴Ӧ�ٶȵ������У���Ӧ��Ŀ�����С��״̬)����Ӧ���Ũ�ȡ��¶ȡ��Ƿ��д����ȣ�
��7�������������غ㶨�ɿ�֪��Ӧ���ɵ���������=6g+100g-105.8g=0.2g��
������������������Ϊx����
Fe + H2SO4===FeSO4 + H2��
56 2
x 0.2g
x=0.2g��56/2=5.6g Fe%=5.6g/6g��100%=93.3%
��������Ʒ����������������93.3% ��������������������=1-93.3%=6.7%����������������3%��Ҫ�����ʲ��ϸ�