题目内容
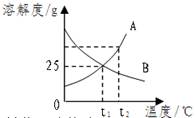
 19、下图是A、B两种物质的溶解度盐线.根据图示回答下列问题:
19、下图是A、B两种物质的溶解度盐线.根据图示回答下列问题:(1)t1℃时,向两只盛有100g水的烧杯中,分别加入A、B两种物质至不能溶解为止,所得溶液的溶质质量分数较大的是
B
溶液(填A或B).(2)t2℃时,欲配制等质量的A、B两种物质的饱和溶液,所需水的质量关系是A
=
B.(填写“>”、“<”或=”,下同)
(3)将t2℃的A、B两种物质的饱和溶液各200g,降温至t1℃,所得溶液的溶质质量分数的大小关系是A
<
B.(4)将t2℃的A、B两种物质的饱和溶液各200g,升温至t3℃,欲使它们仍为饱和溶液,若不改变溶剂质量,所需加入固体溶质的质量关系是A
>
B.(5)若要从混有少量B的A溶液中得到纯净的A,应采用的实验方案是
降温结晶
.分析:(1)比较t1℃二者的溶解度大小,溶解度越大,质量分数越大.
(2)根据质量分数的定义结合溶解度进行分析.
(3)根据t1℃时二者溶液的是否饱和,借助溶解度大小进行比较.
(4)根据溶解度大小进行分析.
(5)物质溶解度随温度变化越大,要使其析出采用降温冷却的方法,若随温度的升高变化不大,采用蒸发结晶法.
(2)根据质量分数的定义结合溶解度进行分析.
(3)根据t1℃时二者溶液的是否饱和,借助溶解度大小进行比较.
(4)根据溶解度大小进行分析.
(5)物质溶解度随温度变化越大,要使其析出采用降温冷却的方法,若随温度的升高变化不大,采用蒸发结晶法.
解答:解:(1)t1℃时B物质的溶解度大于A,溶解度越大溶液溶质的质量分数就越大.
(2)t2℃时二者的溶解度相等,根据质量分数的定义可知,要配制质量相等的饱和溶液,所加的溶质和溶剂的质量应相等.
(3)将二者的饱和溶液由t2℃降温到t1℃,二者均有晶体析出,所得溶液均为饱和溶液,不过此时溶解度A小于B,溶液的溶质的质量分数也就是A小于B.
(4)将二者的饱和溶液由t2℃升温到t3℃二者均变为不饱和溶液,因为二者的溶剂质量相等,此时溶解度A大于B,所以加入溶质的质量A也必须大于B.
(5)A物质溶解度随温度升高变化很大,要使其析出采用降温冷却的方法.
故答案为:
(1)B;(2)=;(3)<;(4)>;(5)降温结晶
(2)t2℃时二者的溶解度相等,根据质量分数的定义可知,要配制质量相等的饱和溶液,所加的溶质和溶剂的质量应相等.
(3)将二者的饱和溶液由t2℃降温到t1℃,二者均有晶体析出,所得溶液均为饱和溶液,不过此时溶解度A小于B,溶液的溶质的质量分数也就是A小于B.
(4)将二者的饱和溶液由t2℃升温到t3℃二者均变为不饱和溶液,因为二者的溶剂质量相等,此时溶解度A大于B,所以加入溶质的质量A也必须大于B.
(5)A物质溶解度随温度升高变化很大,要使其析出采用降温冷却的方法.
故答案为:
(1)B;(2)=;(3)<;(4)>;(5)降温结晶
点评:利用溶解度概念,从混有B的A溶液中得到纯净的A,方法有两种情况,一是若A的溶解度随温度的升高变化不大,采用蒸发结晶法,二是若A的溶解度随温度的升高快速增大,采用冷却结晶法.

练习册系列答案
相关题目
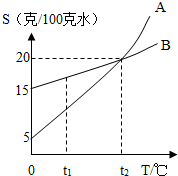 下图是A、B两种物质的溶解度曲线.
下图是A、B两种物质的溶解度曲线.
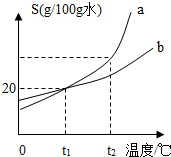 下图是a、b两种物质的溶解度曲线.
下图是a、b两种物质的溶解度曲线.