题目内容
【题目】难溶性杂卤石属于“呆矿”,主要成分有K2SO3、MgSO4、CaSO4,不溶性成分等,可作为一种钾资源。实验室模拟工厂用杂卤石溶浸液制备硫酸钾,流程如下(假设不溶性成分不参加反应):
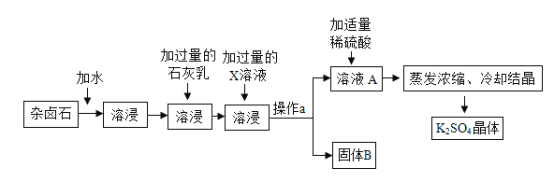
(1)在实验流程中,“加过量的石灰乳”的目的是除去溶浸液中的_______。
(2)X溶液中的溶质是______(写名称)。
(3)固体B中除含有杂卤石中的不溶性成分,还含有加试剂时所产生的______(用化学式表示)。
(4)向溶液A中加稀硫酸时,所发生中和反应的化学方程式为_______。
【答案】MgSO4 碳酸钾 Mg(OH)2和CaCO3 ![]()
【解析】
(1)氢氧化钙与硫酸镁反应生成氢氧化镁白色沉淀和硫酸钙,所以“加过量的石灰乳”的目的是除去溶浸液中的硫酸镁;
(2)除去硫酸钾中的硫酸钙用碳酸钾,碳酸钾与硫酸钙反应生成碳酸钙沉淀和硫酸钾,所以X溶液中的溶质是碳酸钾;
(3)硫酸镁和氢氧化钙反应生成氢氧化镁沉淀、碳酸钾和硫酸钙反应生成碳酸钙沉淀,所以固体B含有杂卤石中的不溶性成分和加试剂时所产生的Mg(OH)2、CaCO3;
(4)碳酸钾与过量的氢氧化钙反应生成碳酸钙和氢氧化钾,所以加入硫酸发生的中和反应是氢氧化钾与硫酸反应生成硫酸钾和水,方程式是:2KOH+H2SO4=K2SO4+2H2O;
故答案为:(1)硫酸镁(2)碳酸钾;(3)Mg(OH)2、CaCO3;(4)2KOH+H2SO4=K2SO4+2H2O。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目