题目内容
【题目】实验室要配制50g 10%的氯化钠溶液,其操作示意图如图所示. 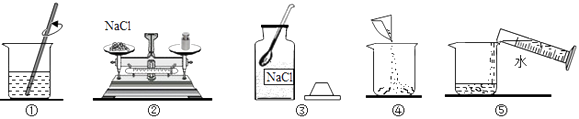
(1)称量氯化钠所用的仪器是(填名称);
(2)①中玻璃棒的作用是;
(3)该实验的正确操作顺序为(填数字序号);
(4)如果前面配制的溶液中溶质的质量分数小于10%,其原因可能有;
A.量筒读数时,视线低于液面
B.固体倒入烧杯时洒落
C.配制时烧杯不干燥
D.装瓶时有液体溅出
(5)若将配制好的50g 10%的氯化钠溶液,稀释为质量分数为5%的氯化钠溶液,需加一定量的水时所用到的仪器是(填名称);加水的质量为g.
【答案】
(1)托盘天平
(2)搅拌加速食盐的溶解
(3)③②④⑤①
(4)ABC
(5)量筒;50
【解析】解:(1)称量氯化钠所用的仪器是 托盘天平(填名称);(2)①中玻璃棒的作用是 搅拌加速食盐的溶解;(3)配制溶液的步骤是:计算、称量、溶解、装瓶存放,因此实验的正确操作顺序为:③②④⑤①;(4)A.量筒读数时,视线低于液面,则水偏多,故配制的溶液中溶质的质量分数小于10%;B.固体倒入烧杯时洒落,造成溶质少了,将导致溶质质量分数偏小;
C.配制时烧杯不干燥,造成溶剂质量偏大,将导致溶质质量分数偏小;
D.装瓶时有液体溅出,溶质质量分数无影响;
所以实际配制的溶液中溶质的质量分数小于10%,其原因可能有ABC.(5)设稀释后所得5%的氯化钠溶液质量为x,则50g×10%=5%×x,解得x=100g.则需加水的质量为:100g﹣50g=50g.
所以答案是:(1)托盘天平;(2)搅拌加速食盐的溶解;(3)③②④⑤①;(4)ABC;(5)量筒; 50.

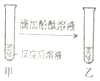
【题目】小明在做“盐酸中和氢氧化钠”的实验时,实验前忘记向氢氧化钠溶液中滴加酚酞溶液,导致无法判断中和反应进行的程度,于是小明对反应后溶液的酸碱性进行了探究. 【探究目的】确定反应后溶液的酸碱性
(1)【猜想与假设】反应后溶液呈碱性,也可能呈 , 也可能呈 .
(2)【实验验证】
实验操作 | 实验现象 | 实验结论 |
| 无色酚酞溶液; | 溶液呈碱性,使其呈碱性的微粒是; |
无色酚酞溶液不变色 | 溶液呈; |
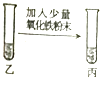
(3)【继续验证】
实验操作 | 实验现象 | 实验结论 |
| 粉末部分或全部消失,溶液变为黄色 | 溶液呈 , 反应的化学方程式是; |
溶液呈; |