题目内容
工业上用煅烧石灰石(主要成分为CaCO3)制取生石灰,其生产流程图如下:
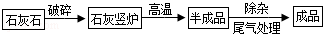
(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是 t.
(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)
【答案】
9;8.04t
【解析】
试题分析:(1)碳酸钙的质量=12t×75%=9t;
(2)设生成氧化钙的质量为x.则
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56
9t x
 =
= ,
,
解之得:x=5.04t
因为生成的生石灰中含有未参与反应的杂质,杂质的质量=12t×(1﹣75%)=3t
所以最终可以生产生石灰的质量=5.04t+3t=8.04t
答:可生产生石灰8.04t.
考点:含杂质物质的化学反应的有关计算.

练习册系列答案
相关题目
下列化学方程式符合题意且书写正确的是( )
| A、正常雨水的pH为5.6的原因CO2+H2O═H2CO3 | B、用盐酸除去铁器表面的铁锈FeO+2HCl═FeCl2+H2O | C、工业上用煅烧石灰石的方法制生石灰CaCO3═CaO+CO2 | D、证明铁的金属活动性比氢强2Fe+3H2SO3═Fe2(SO4)3+3H2↑ |