题目内容
铁、铜是我们生活中重要的金属材料。
(1)将油漆涂在铁艺家具上防止生锈,其目的是将铁与空气中的 隔绝。
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,发生的化学方程式为 。
(3)矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用。欲从含有硫酸、硫酸亚铁和硫酸铜的废液中,回收全部铜。处理过程如下:
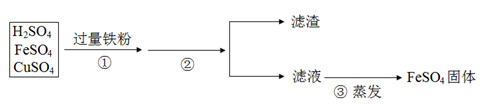
步骤①加入过量铁粉,发生的反应方程式为: , 。充分反应后步骤②进行的操作是 ,得到的滤渣中含有 ,继续处理可以得到纯净的金属铜和硫酸亚铁固体。
(1)将油漆涂在铁艺家具上防止生锈,其目的是将铁与空气中的 隔绝。
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,发生的化学方程式为 。
(3)矿物的储量有限,而且不可再生,我们必须保护金属资源并进行金属的回收利用。欲从含有硫酸、硫酸亚铁和硫酸铜的废液中,回收全部铜。处理过程如下:

步骤①加入过量铁粉,发生的反应方程式为: , 。充分反应后步骤②进行的操作是 ,得到的滤渣中含有 ,继续处理可以得到纯净的金属铜和硫酸亚铁固体。
(1)氧气和水
(2)3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(3)Fe+CuSO4 Cu+FeSO4 Fe+H2SO4 FeSO4+H2↑ 过滤 Cu和Fe
(2)3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2(3)Fe+CuSO4 Cu+FeSO4 Fe+H2SO4 FeSO4+H2↑ 过滤 Cu和Fe
分析:(1)根据对铁生锈的认识,分析涂油漆防止生锈的原理;
(2)根据氧化还原反应发生的规律,写出还原剂一氧化碳还原氧化铁的化学方程式;
(3)根据金属活动顺序表中铁、铜的金属活动性强弱去作答,两种金属的金属活动性由强到弱的顺序为铁>氢>铜.
解答:解:(1)涂油漆可使铁不再接触空气中的水和氧气,而不能继续被锈蚀;
(2)一氧化碳高温下与氧化铁反应,生成铁和二氧化碳,化学方程式为3CO+Fe2O3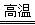 2Fe+3CO2;
2Fe+3CO2;
(3)根据金属活动性铁>氢>铜,加入的铁粉与硫酸、硫酸铜发生反应,化学方程式为Fe+CuSO4═Cu+FeSO4、Fe+H2SO4═FeSO4+H2↑;充分反应后把固体过滤分离,可得到铁与铜的混合物;
故答案为:
(1)氧气和水;
(2)3CO+Fe2O3 2Fe+3CO2;
2Fe+3CO2;
(3)Fe+CuSO4═Cu+FeSO4;Fe+H2SO4═FeSO4+H2↑;过滤;Fe Cu.
(2)根据氧化还原反应发生的规律,写出还原剂一氧化碳还原氧化铁的化学方程式;
(3)根据金属活动顺序表中铁、铜的金属活动性强弱去作答,两种金属的金属活动性由强到弱的顺序为铁>氢>铜.
解答:解:(1)涂油漆可使铁不再接触空气中的水和氧气,而不能继续被锈蚀;
(2)一氧化碳高温下与氧化铁反应,生成铁和二氧化碳,化学方程式为3CO+Fe2O3
 2Fe+3CO2;
2Fe+3CO2;(3)根据金属活动性铁>氢>铜,加入的铁粉与硫酸、硫酸铜发生反应,化学方程式为Fe+CuSO4═Cu+FeSO4、Fe+H2SO4═FeSO4+H2↑;充分反应后把固体过滤分离,可得到铁与铜的混合物;
故答案为:
(1)氧气和水;
(2)3CO+Fe2O3
 2Fe+3CO2;
2Fe+3CO2;(3)Fe+CuSO4═Cu+FeSO4;Fe+H2SO4═FeSO4+H2↑;过滤;Fe Cu.

练习册系列答案
相关题目

