题目内容
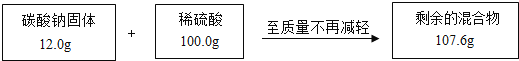
【题目】(10分)某兴趣小组为测定一包碳酸钠样品中碳酸钠的质量分数,进行实验.测得相关数据如图所示:
提示:①反应原理![]()
②样品中的杂质不参加反应
③计算结果保留一位小数
(1)根据质量守恒定律,反应生成二氧化碳的质量为 g.
(2)计算该样品中碳酸钠的质量分数.(写出计算过程)
【答案】解:(1)根据质量守恒定律可知,反应前后混合物减少的质量就是生成二氧化碳的质量,所以反应生成二氧化碳的质量=12.0g+100.0g﹣107.6g=4.4g;故填:4.4;
(2)设样品中碳酸钠的质量为x.
![]()
106 44
x 4.4g
![]()
x=10.6g
该样品中碳酸钠的质量分数=![]() =88.3%
=88.3%
答:该样品中碳酸钠的质量分数为88.3%.
【解析】
试题分析:反应中减少的质量是生成的气体二氧化碳的质量;根据二氧化碳的质量计算出碳酸钠的质量,进而计算出碳酸钠的质量分数;

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】(10分)随着对“火”的认识和使用,人类能够更好地改造自然、改善生活.
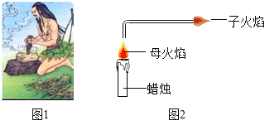
(1)如图1所示,古人“钻木取火”过程中,快速搓动木棍使底部的干草着火,从“燃烧条件”分析:“钻木”为干草燃烧提供的条件是 ;
(2)形状大小相同的木炭在下列气体中燃烧的现象如表所示,回答问题:
不同气体中 | 在空气中 | 在氧气中 | 在臭氧中 |
实验现象 | 红热 | 剧烈燃烧 | 非常剧烈地燃烧 |
生成的气体能使澄清石灰水变浑浊 | |||
①木炭在空气中和氧气中燃烧现象不同的原因是(答一点) .
②生成的气体使澄清石灰水变浑浊的化学方程式 .
③根据表中信息,写一条对“燃烧条件”的新认识 .
④木炭在臭氧(![]() )中燃烧的化学方程式为 .
)中燃烧的化学方程式为 .
(3)如图2所示,1860年英国化学家法拉第做了一个有趣的“母子火焰”实验.经研究:子火焰中燃烧物为石蜡蒸汽,子火焰为石蜡蒸汽燃烧产生的.
①蜡烛能产生子火焰这一现象,证明石蜡具有的物理性质是 (写一点,下同),化学性质是 .
②该实验成功的关键因素之一是导气管不宜太长,其原因是 。