题目内容
 (2008?益阳)(1)启封前该瓶浓硫酸溶液的质量是多少?
(2008?益阳)(1)启封前该瓶浓硫酸溶液的质量是多少?(2)取该浓硫酸10g中配制成19.6%的稀硫酸多少克?
(3)向一定量的NaOH溶液中加入10g上述配制的稀硫酸,恰好完全反应,试计算:(提示:2NaOH+H2SO4=Na2SO4+2H2O)
①参加反应的NaOH的质量是多少?
②若要计算反应后溶液质的质量分数,题中还缺少的一个数据是______.(可能用到的相对原子质量:H-1;Na-23;O-16;S-32)
【答案】分析:(1)读取标签中该瓶浓硫酸的体积和密度,利用m=ρV计算该瓶浓硫酸的质量;
(2)根据稀释前后溶液中硫酸的质量不变,由标签中浓硫酸的质量分数求得10g浓硫酸中溶质硫酸的质量,利用溶质硫酸的质量和稀硫酸的溶质质量分数计算出所配制稀硫酸的溶液的质量;
(3)根据反应的化学方程式,由参加反应硫酸的质量计算出恰好完全反应时参加反应氢氧化钠的质量;如果已知氢氧化钠溶液的质量或氢氧化钠溶液的质量分数,可利用质量守恒定律计算反应后溶液的质量,而计算出反应后溶液质的质量分数.
解答:解:(1)启封前该瓶浓硫酸溶液的质量=500mL×1.84g/cm3=920g
(2)取该浓硫酸10g中配制成19.6%的稀硫酸=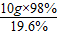 =50g
=50g
(3)①设参加反应的NaOH的质量为x.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 10g×19.6%
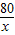 =
=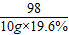
x=1.6g
答:启封前该瓶浓硫酸溶液的质量是920g;取该浓硫酸10g中配制成19.6%的稀硫酸50g;参加反应的NaOH的质量是1.6g;
②根据所加稀硫酸中溶质硫酸的质量,可计算反应后所得溶液中溶质硫酸钠的质量;如果已知氢氧化钠溶液的质量或氢氧化钠溶液的质量分数,可利用质量守恒定律,计算出反应后所得溶液质量;利用溶质的质量分数计算公式就可完成反应后溶液质的质量分数的计算;
故答案为:NaOH溶液的质量或NaOH溶液的质量分数.
点评:根据反应的化学方程式可表示反应中各物质的质量关系,由反应中某物质的质量可计算反应中其它物质的质量.
(2)根据稀释前后溶液中硫酸的质量不变,由标签中浓硫酸的质量分数求得10g浓硫酸中溶质硫酸的质量,利用溶质硫酸的质量和稀硫酸的溶质质量分数计算出所配制稀硫酸的溶液的质量;
(3)根据反应的化学方程式,由参加反应硫酸的质量计算出恰好完全反应时参加反应氢氧化钠的质量;如果已知氢氧化钠溶液的质量或氢氧化钠溶液的质量分数,可利用质量守恒定律计算反应后溶液的质量,而计算出反应后溶液质的质量分数.
解答:解:(1)启封前该瓶浓硫酸溶液的质量=500mL×1.84g/cm3=920g
(2)取该浓硫酸10g中配制成19.6%的稀硫酸=
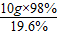 =50g
=50g(3)①设参加反应的NaOH的质量为x.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 10g×19.6%
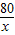 =
=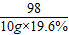
x=1.6g
答:启封前该瓶浓硫酸溶液的质量是920g;取该浓硫酸10g中配制成19.6%的稀硫酸50g;参加反应的NaOH的质量是1.6g;
②根据所加稀硫酸中溶质硫酸的质量,可计算反应后所得溶液中溶质硫酸钠的质量;如果已知氢氧化钠溶液的质量或氢氧化钠溶液的质量分数,可利用质量守恒定律,计算出反应后所得溶液质量;利用溶质的质量分数计算公式就可完成反应后溶液质的质量分数的计算;
故答案为:NaOH溶液的质量或NaOH溶液的质量分数.
点评:根据反应的化学方程式可表示反应中各物质的质量关系,由反应中某物质的质量可计算反应中其它物质的质量.

练习册系列答案
相关题目
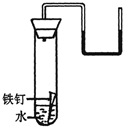 (2008?益阳)如图所示,在盛水的试管中放入一根洁净的铁钉,用带U形管的胶塞塞紧,U型管内水面处于同一高度,一周后观察铁钉和U型管内水面变化( )
(2008?益阳)如图所示,在盛水的试管中放入一根洁净的铁钉,用带U形管的胶塞塞紧,U型管内水面处于同一高度,一周后观察铁钉和U型管内水面变化( ) (2008?益阳)材料一:从今年6月1日起,我国全面用电子机票取代纸制机票.
(2008?益阳)材料一:从今年6月1日起,我国全面用电子机票取代纸制机票. (2008?益阳)如图是固体A的溶解度曲线示意图,下表是固体B在不同温度时的溶解度.
(2008?益阳)如图是固体A的溶解度曲线示意图,下表是固体B在不同温度时的溶解度.