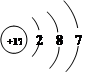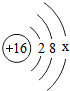题目内容
化学是研究物质组成、结构、性质及其变化规律的基础自然科学,请回答:
(1)从组成角度看:氯化钠是由 组成.
(2)从微粒角度看:氯化钠是由 构成(用微粒符号表示).
(3)从制备角度看:将海水进行 可得到粗盐.除去粗盐中含有的SO42﹣、Ca2+、Mg2+等杂质,常加入过量的①Na2CO3溶液、②BaCI2溶液、③NaOH溶液,三种试剂的加入顺序为 (填序号).碳酸钠和盐酸反应液能生成氯化钠,工业上不用此反应制备氯化钠的原因是 .
(4)从变化角度看:将氯化钠和水在通电条件下反应能生成一种碱、氢气和氯气(CI2),该反应的化学方程式为 .高中化学反应分为两类,一类是有元素的化合价升降的化学反应是氧化还原反应,另一类是反应前后元素化合价都没有改变的是非氧化还原反应,据此判断上述反应的类型为 .
(1)钠元素和氯元素 (2)Na+、Cl﹣
(3)蒸发结晶;②③①或③②①或②①③;碳酸钠、盐酸的成本比氯化钠高
(4)2NaCl+2H2O Cl2↑+H2↑+2NaOH;氧化还原反应.
Cl2↑+H2↑+2NaOH;氧化还原反应.
解析试题分析:(1)从组成角度看氯化钠是由钠元素和氯元素组成;
(2)从微粒角度看氯化钠是由钠离子和氯离子构成;
(3)氯化钠的溶解度受温度影响变化不大,所以从制备角度看:将海水进行蒸发结晶可得到粗盐;NaOH溶液除镁离子、BaCI2溶液除去硫酸根离子、而Na2CO3溶液为了除去钙离子以及过量的钡离子,所以常加入过量的①Na2CO3溶液、②BaCI2溶液、③NaOH溶液,三种试剂的加入顺序为②③①或③②①或②①③;碳酸钠和盐酸反应液能生成氯化钠,工业上不用此反应制备氯化钠的原因是碳酸钠、盐酸的成本比氯化钠高;
(4)氯化钠和水在通电条件下反应能生成氢氧化钠、氢气和氯气,该反应的化学方程式为2NaCl+2H2O Cl2↑+H2↑+2NaOH,该反应中氯元素的化合价由﹣1价变为0价,而氢元素的化合价由+1价变为0价,所以属于氧化还原反应.
Cl2↑+H2↑+2NaOH,该反应中氯元素的化合价由﹣1价变为0价,而氢元素的化合价由+1价变为0价,所以属于氧化还原反应.
考点:分子、原子、离子、元素与物质之间的关系;氯化钠与粗盐提纯;盐的化学性质;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
点评:本题考查了常见物质的组成、结构、性质及变化规律,要加强基础知识的记忆.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案化学用语是学习化学的重要工具.
(1)写出下列微粒的化学符号:
铝原子 ;氧气分子 ;二氧化碳分子 ;镁离子 .
(2)用下列字母序号填空:
| A.NaHCO3 | B.Ca(OH)2 | C.KMnO4 | D.C2H5OH |
③ 可用作改良酸性土壤;④ 可用作实验室制取氧气
(3)写出下列反应的化学方程式:
①碳酸钠溶液与石灰水
②铜与硝酸银溶液
③用双氧水制取氧气
④硝酸铵受热分解生成N2O气体和水 .
元素周期表是学习和研究化学的重要工具,下表是元素周期表的一部分:
| ⅢA | ⅣA | ⅤA | ⅥA |
| 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 |
| 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 |
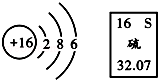
(1)请你写出15号元素的名称 磷 .
(2)从原子结构看,氧和硫同属ⅥA(第六主族)的原因是 .
(3)上表中 元素(填元素符号)是地壳中含量最多的金属元素.
(4)写出13号元素和16号元素的单质在高温下化合的化学方程式 .