题目内容
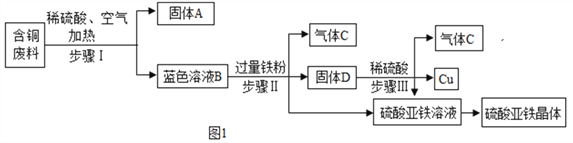
【题目】某金属冶炼厂在生产过程中产生了一定量的含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并获得硫酸亚铁晶体。其设计方案如图1所示。
【查阅资料】
①在同温同压下,同体积的气体含有相同的分子数目;
②在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜,反应的化学方程式:2Cu+2H2SO4+O2![]() 2CuSO4+2H2O。
2CuSO4+2H2O。
【回答问题】
(1)步骤Ⅰ中分离得到固体A和蓝色溶液B的操作名称是___________。
(2)蓝色溶液B中的溶质是___________(填化学式)。
(3)写出步骤Ⅲ中发生反应的化学方程式__________________________________。
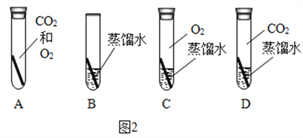
(4)铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3].根据铜锈的主要成分中含有氢元素和碳元素,可以判断出铜生锈需要空气中的_________(填化学式)。若要探究“铜生锈是否需要空气中的氧气?”如图2所示实验中,只需完成________(填字母)两个实验即可达到实验目的。
【拓展研究】
(1)小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图3),9分钟以后测得数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量气管内液面所在刻度 | 量气管内液面所在刻度 |
150.0 mL | 30.8mL | 0.2mL |
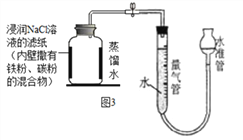
①请计算出空气中氧气含量__________(计算结果保留一位小数)。
②炭粉和氯化钠在本实验中的作用是________________________。
③若将图3装置中的粗铁粉换成足量的铜粉进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由。__________________________________________________________
【答案】 过滤 CuSO4和H2SO4 Fe+ H2SO4== FeSO4+ H2↑ H2O和CO2 BD 20.4% 催化作用 空气中的二氧化碳的含量较少,铜不能将空气中的氧气完全反应。
【解析】(1)固液分离的步骤是过滤;
(2)首先铜与氧气在加热的条件下生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜,故蓝色溶液的溶质是CuSO4,向蓝色溶液中加入过量的铁粉发现有气泡冒出,说明蓝色溶液中有过量的硫酸,故溶质为CuSO4和H2SO4 ;
(3)向硫酸铜溶液中加入过量的铁粉后可得到固体D中含有生成的铜和过量的铁,步骤Ⅲ是过量的铁与稀硫酸反应形成氢气和硫酸亚铁,反应方程式为:Fe+ H2SO4 == FeSO4 + H2↑;
(4)Cu2(OH)2CO3中含有铜元素、氢元素、碳元素、氧元素,根据质量守恒定律,铜生锈需要空气中的H2O和CO2;若要探究“铜生锈是否需要空气中的氧气?”如图2所示实验中,只需完成BD即可;
【拓展研究】
(1)①量气管内的水变化的体积为氧气的体积=30.8mL-0.2mL=30.6Ml,空气中氧气的体积含量为: ![]() ;
;
②通过上述实验探究,选择碳粉和氯化钠在本实验中较快的完成实验,并减小误差,故碳粉和氯化钠在本实验中是催化剂,起催化作用;
③铜可以与空气中的氧气、二氧化碳和水反应生成铜绿,若将铁换成铜进行实验,不能比较准确的测定空气中的氧气的含量,因为空气中的二氧化碳的含量较少,铜不能将空气中的氧气完全反应。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案