题目内容
7.根据化学方程式计算,3.6克水电解可以产生多少克氧气和氢气?分析 依据水的质量并结合电解水的化学方程式可计算生成氧气和氢气的质量.
解答 解:设3.6g水电解产生氧气的质量为x,氢气的质量为y
2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
36 4 32
3.6g y x
$\frac{36}{3.6g}=\frac{4}{y}=\frac{32}{x}$
x=3.2g
y=0.4g
答案:3.6克水电解可以产生3.2克氧气和0.4氢气.
点评 本题难度不大,了解方程式解题的格式、反应方程式等即可顺利解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.类推是化学学习中常用的思维方法.现有以下类推结果:①单质含有一种元素,含有一种元素的物质为单质;②物质与氧气发生的反应为氧化反应,氧化反应一定是物质与氧气发生的反应;③原子不显电性,不显电性的粒子是原子:④金属能导电,能导电的一定是金属.其中错误的是( )
| A. | 全部 | B. | 只有①③④ | C. | 只有①②④ | D. | 只有①②③ |
15.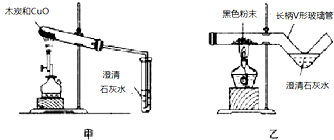 我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动.
我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动.
【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
高温
【查阅资料】
(1)木炭与CuO的反应是:C+2CuO═2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应得到铜和硫酸铜溶液:Cu2O+H2SO4═Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③既有Cu也有Cu2O.
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再也少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水变浑浊,写出该反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
【评价反思】
(1)使用图乙装置与使用图甲装置相比,其优点是节约药品(写出1条即可).
(2)若要证明CaC12是该反应的催化剂,还需要验证CaCl2的质量和化学性质在反应前后不变.
 我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动.
我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(见图甲),又能用改进的微型实验装置(见图乙).化学兴趣小组采用图乙装置,开展以下探究活动. 【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
高温
【查阅资料】
(1)木炭与CuO的反应是:C+2CuO═2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu2O是红色固体,能与稀硫酸反应得到铜和硫酸铜溶液:Cu2O+H2SO4═Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③既有Cu也有Cu2O.
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再也少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水变浑浊,写出该反应的化学方程式Ca(OH)2+CO2=CaCO3↓+H2O
(3)待玻璃管冷却后,提取里面的红色固体,进行如下的验证:
| 步骤 | 现象 | 结论 |
| Ⅰ.取1.44g红色固体装入试管,滴入足量 的稀硫酸,充分反应 | 红色固体部分减少,溶液变 为蓝色色 | 猜想①错误 |
| Ⅱ.滤出试管中残留的红色固体,洗涤干燥 称其质量为1.04g | 猜想③正确 |
(1)使用图乙装置与使用图甲装置相比,其优点是节约药品(写出1条即可).
(2)若要证明CaC12是该反应的催化剂,还需要验证CaCl2的质量和化学性质在反应前后不变.
12.物质的组成、结构、性质关系归纳错误的是( )
| A. | 核内质子数决定了元素的种类 | |
| B. | 元素的化学性质与原子的最外层电子数关系密切 | |
| C. | 金刚石与石墨的组成元素相同,因此性质完全相同 | |
| D. | 物质由原子、分子、离子等粒子构成 |
19.按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便.下列各组物质中符合单质-化合物-混合物”顺序排列的是( )
| A. | 氖气、金刚石、空气 | B. | 一氧化碳、二氧化碳、石灰石 | ||
| C. | 氢气、二氧化碳、石灰石 | D. | 液氧、水、过氧化氢 |
17.下列反应不属于化合反应,也不属于分解反应的是( )
| A. | 高锰酸钾加热分解 | B. | 蜡烛燃烧 | ||
| C. | 过氧化氢加入二氧化锰分解 | D. | 铁在氧气中燃烧 |