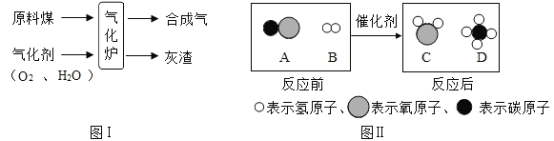
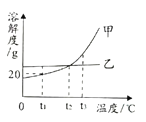
题目内容
【题目】实验一:根据如图回答问题。
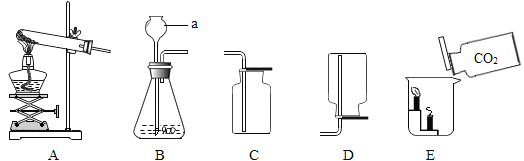
(1)仪器a的名称是_____。
(2)实验室制取氧气时,选用的收集装置是_____(选填字母标号,下同)。写出铁丝在氧气中燃烧的化学方程式_____。
(3)实验室用大理石和稀盐酸制取二氧化碳化学方程式为_____,选用的发生装置图_____。如E图所示,将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,产生该现象的原因是二氧化碳不燃烧,不支持燃烧和_____。
实验二:已知Fe2O3样品中含有杂质FeS2.兴趣小组用下图装置测定样品中FeS2含量。称取mg样品置于玻璃管Y内。充分灼烧该样品,根据实验后装置Z增加的质量推算FeS2质量(装置管内发生反应:4FeS2+11O2![]() 2Fe2O3+8SO2)
2Fe2O3+8SO2)
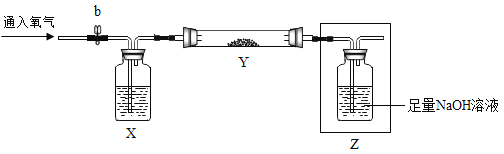
(4)连接好仪器,检查整套装置的气密性:在装置Z中加水至浸没长导管末端,关闭开关b,加热玻璃管Y,观察到_____,说明装置气密性良好。
(5)使用“实验一”装置B制得的氧气进行实验,装置X瓶内需盛放的干燥剂是_____。玻璃管Y内反应完全后,停止加热,若立即停止通入氧气,会导致误差,其原因是_____。
(6)试验后测得Z质量增加6.4g(忽略装置Z中水分挥发),则样品中FeS2为_____g。
(7)若将通入的氧气改为空气进行同样的实验(样品反应完全),则测得FeS2含量_____(选填“偏大”“偏小”或“无影响”)数据。
【答案】长颈漏斗 C 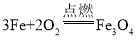 CaCO3+2HCl=CaCl2+H2O+CO2↑ B 密度比空气大 装置Z处导管口有气泡冒出,停止加热后一段时间,长导管内液面上升 浓硫酸 生成的气体没有全部被吸收 6 偏大
CaCO3+2HCl=CaCl2+H2O+CO2↑ B 密度比空气大 装置Z处导管口有气泡冒出,停止加热后一段时间,长导管内液面上升 浓硫酸 生成的气体没有全部被吸收 6 偏大
【解析】
(1)仪器a的名称是长颈漏斗。故答案为:长颈漏斗;
(2)氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法或排水法收集。铁和氧气在点燃的条件下生成四氧化三铁。故答案为:C、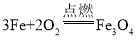 ;
;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸在常温下混合制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,发生装置应该选择固液混合不加热。将二氧化碳倒入烧杯中,观察到燃烧的蜡烛自下而上依次熄灭,由于二氧化碳不燃烧、不支持燃烧,所以蜡烛熄灭。下层的蜡烛先熄灭上层的蜡烛后熄灭,说明二氧化碳先聚集在烧杯底部,则二氧化碳的密度比空气大。故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑、B、密度比空气大;
(4)检查整套装置的气密性:在装置Z中加水至浸没长导管末端,关闭开关b,加热玻璃管Y。Y中的空气受热膨胀,会逸散到左右两只集气瓶中。由于左侧的X装置关闭了开关b,则无明显现象。受热膨胀的空气进入到右侧的Z装置后,观察到装置Z处导管口有气泡冒出。停止加热后一段时间,由于温度恢复到室温,则压强逐渐减小,则外界气压会将Z装置中的液体压入长导管内,使液面上升。故答案为:装置Z处导管口有气泡冒出,停止加热后一段时间,长导管内液面上升;
(5)氧气可以用浓硫酸、碱石灰来干燥。而X装置中盛放的是液体,则X内盛放的是浓硫酸。玻璃管Y内反应完全后,停止加热,若立即停止通入氧气,则会使一部分二氧化硫无法被吸收,从而会导致误差。故答案为:浓硫酸、生成的气体没有全部被吸收;
(6)实验后测得装置Z的质量增加6.4g,则生成的二氧化硫的质量为6.4g。
设FeS2的质量为![]() 。
。
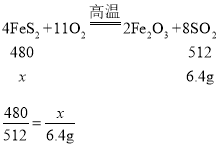
解得![]() =6g。所以样品中,FeS2的质量为6g。故答案为:6;
=6g。所以样品中,FeS2的质量为6g。故答案为:6;
(7)若将通入的氧气改为空气进行同样的实验,由于空气中的二氧化碳也能被氢氧化钠溶液吸收,使测得的二氧化硫气体质量偏大,所以会导致FeS2含量偏大。故答案为:偏大。

【题目】下列对客观事实书写的化学方程式及其反应类型都正确的是( )
选项 | 客观事实 | 化学方程式 | 基本反应类型 |
A | 铁丝在氧气中燃烧 | 2Fe+3O2 | 化合反应 |
B | 加热高锰酸钾 | 2KMnO4 | 分解反应 |
C | 乙醇燃烧 | C2H5OH+3O2 | 氧化反应 |
D | 硫酸钾溶液和氯化钡溶液反应 | K2SO4+BaCl2=2KCl +BaSO4 | 复分解反应 |
A.AB.BC.CD.D