题目内容
【题目】为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不参与反应,也不溶于水)请计算: 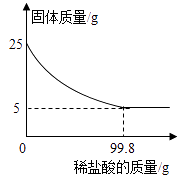
(1)这种贝壳中碳酸钙的质量分数是 .
(2)25g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数.
【答案】
(1)80%
(2)解:由图可以看出固体减少了20g,即碳酸钙的质量为20g,
设恰好反应时,生成氯化钙的质量为x,同时产生二氧化碳的质量为y
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 111 | 44 | |
20g | x | y |
![]() =
= ![]() =
= ![]()
x=22.2g
y=8.8g
所得溶液中溶质的质量分数= ![]() ×100%=20%
×100%=20%
答:25g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为20%
【解析】解:由图可以看出固体减少了20g,即碳酸钙的质量为20g,所以贝壳中碳酸钙的质量分数为 ![]() ×100%=80%
×100%=80%
设恰好反应时,生成氯化钙的质量为x,同时产生二氧化碳的质量为y
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 111 | 44 | |
20g | x | y |
![]() =
= ![]() =
= ![]()
x=22.2g
y=8.8g
所得溶液中溶质的质量分数= ![]() ×100%=20%
×100%=20%
答:(1)这种贝壳中碳酸钙的质量分数是 80%.(2)25g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为20%
【考点精析】掌握根据化学反应方程式的计算是解答本题的根本,需要知道各物质间质量比=系数×相对分子质量之比.

 阅读快车系列答案
阅读快车系列答案【题目】镁被誉为“国防金属”,工业上通常用海水制取金属镁,有以下两个方案: 方案一: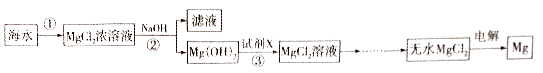
方案二: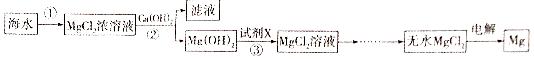
请回答下列问题:
(1)每吨试剂价格表:
试剂 | NaOH | Ca(OH)2 |
价格(元/t) | 3200 | 1200 |
工业生产为了获得更高的利润,根据上表分析,最好选择方案(填“一”或“二”).
(2)步骤②中加入试剂充分反应后的操作是;
(3)步骤③发生反应的化学方程式;
(4)在MgCl2 ![]() Mg+Cl2↑反应中化合价发生变化的元素有种.
Mg+Cl2↑反应中化合价发生变化的元素有种.