题目内容
有一包不纯的CaCO3样品,其中只含一种杂质,现取该样品5克与足量稀盐酸反应生成2.3克CO2,则所混杂质可能是( )A.K2CO3
B.Na2CO3
C.MgCO3
D.KHCO3
【答案】分析:要计算含有的另一种杂质,可以根据极值法先计算5纯碳酸钙能生成的二氧化碳的质量,然后根据平均值法确定另一种杂质即可.
解答:解:设5g纯碳酸钙能生成二氧化碳的质量是x,则有
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
5g x
 =
=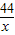
解得:x=2.2g;
现在不纯的碳酸钙得到2.3g二氧化碳,根据平均值法,所含有杂质应符合相同质量的杂质与盐酸反应比等质量碳酸钠与盐酸反应生成的CO2更多的要求;
结合选项中四种碳酸盐的组成特点,即所含杂质的相对分子质量应当小于CaCO3;
故判断所混有的杂质为碳酸镁.
故选C.
点评:本题考查了混合碳酸盐与酸反应生成二氧化碳质量,完成此题,需使用极值法和平均值法.
解答:解:设5g纯碳酸钙能生成二氧化碳的质量是x,则有
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
5g x
 =
=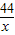
解得:x=2.2g;
现在不纯的碳酸钙得到2.3g二氧化碳,根据平均值法,所含有杂质应符合相同质量的杂质与盐酸反应比等质量碳酸钠与盐酸反应生成的CO2更多的要求;
结合选项中四种碳酸盐的组成特点,即所含杂质的相对分子质量应当小于CaCO3;
故判断所混有的杂质为碳酸镁.
故选C.
点评:本题考查了混合碳酸盐与酸反应生成二氧化碳质量,完成此题,需使用极值法和平均值法.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
有一包不纯的CaCO3样品,其中只含一种杂质,现取该样品5克与足量稀盐酸反应生成2.3克CO2,则所混杂质可能是( )
| A、K2CO3 | B、Na2CO3 | C、MgCO3 | D、KHCO3 |