��Ŀ����
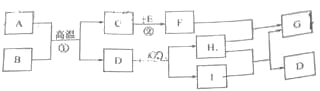
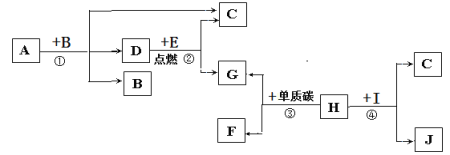
����Ŀ����2017ʯ��ׯ����������ģ����ͼ��ʾA��F�dz��л����������ʡ�ͼ����������ʾת����ϵ����������ʾ��ܷ�Ӧ���������ʺͷ�Ӧ����δ�����������A������θҺ�к��е��ᣬA��B�����кͷ�Ӧ�ɵõ������г��õ�һ�ֵ�ζƷ������C�����ڸ�������������
��1��A�Ļ�ѧʽΪ_____��
��2�����ó��ڷ��õ�B�����ڿ�������ˮ���⣬�˹�����___������������������ѧ�����仯��
��3��E��F�����������ͬ����E��F�ܷ�Ӧ���ȣ�FҲ����A��Һ������Ӧ����F��A��Ӧ�Ļ�ѧ����ʽΪ________��
��4��C��D��Ӧ�ɵõ�B����C��D��Ӧ�Ļ�ѧ����ʽΪ________��
���𰸡�HCl ���� CaO��2HCl= CaCl2��H2O Na2CO3��Ca��OH��2= CaCO3����2NaOH
��������
�����ҵ�ͻ�ƿ���A������θҺ�к��е���������֪AΪHCl������A��B�����кͷ�Ӧ�ɵõ������г��õ�һ�ֵ�ζƷ��˵��B�Ǽ��ζƷΪNaCl����B��NaOH��NaOH�ڿ�������ˮ�������������仯������C�����ڸ�������������˵��C��Ca��OH��2��A��B��C�������ʶ�����ת��ΪE��A��B��C��������Ԫ�أ�����A��B��C�Ļ�ѧ���ʣ������ж�EΪH2O��Eת��ΪC����ͨ��CaO �� H2O === Ca��OH��2��Ӧ���С�E��F�����������ͬ��˵��FҲ���������E��F��Ӧ���ȣ�˵��F��CaO��F��A��Ӧ�Ļ�ѧ����ʽΪCaO �� 2HCl=== CaCl2 �� H2O ���˷�ӦҲ��Fת��ΪE�ķ�Ӧ�� D����ͼ�ܷ�Ӧ�������ж�DΪ�Σ�C��D��Ӧ���Եõ�B�������ж�DΪ���Σ��������ܺ����ᷴӦ������ӦΪNa2CO3 ��C��D��Ӧ�ķ���ʽΪNa2CO3��Ca��OH��2=== 2NaOH �� CaCO3����

����Ŀ������ʵ��������ܴﵽʵ��Ŀ�ĵ���
ѡ�� | Ŀ�� | ��Ҫ���� |
A | �����ë��Ʒ����� | ȡ�������գ�����ζ |
B | ���������е��۵Ĵ��� | ȡ�����μ�������� |
C | ����������������Ϊ5%��������Һ | ȡ5g���ǣ�����100gˮ |
D | ��ȥ�Ȼ�����Һ�л��е��������� | �ӹ�����̼��ƣ����裬���� |
A.AB.BC.CD.D