题目内容
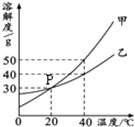 甲、乙两种固体物质的溶解度曲线如图所示.
甲、乙两种固体物质的溶解度曲线如图所示.(1)图中P点的含义是
20℃时,甲和乙的溶解度相等
20℃时,甲和乙的溶解度相等
.(2)40℃时,饱和溶液中溶质的质量分数:甲
>
>
乙(填“>”、“=”或“<”).20℃时,将50g乙物质放入100g水中,所得溶液中,溶解的溶质与溶剂的质量比为3:10
3:10
(用最简整数比表示).20℃100g水加入甲20g加热至40℃降温至20℃A B 加入甲0gC 加入甲20gD E
(3)20℃时,进行了如图所示的实验:
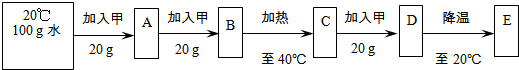
上述实验过程中所得的溶液,属于不饱和溶液的是
AC
AC
(填写序号),E
E
溶液与B溶液中溶质的质量分数相同.分析:(1)图中点P是20℃时甲和乙的溶解度相等,都等于30g;
(2)根据40℃时甲大于乙的溶解度,该温度下饱和溶液的溶质质量分数=
×100%解答;
(3)根据20℃时甲的溶解度相等都等于30g,可知该温度下100g水中做多溶解30g该物质,所以A能溶得到的是饱和溶液;再加入20g甲能溶解10g,所以B饱和;加热至40℃时甲的溶解度为50g,说明100g水中在此温度下可溶解50克甲,只加了40g甲物质,所得溶液C为不饱和溶液;再加入20g甲能溶解10g,D溶液饱和;降温到20℃时,溶解度降低所得溶液E饱和.
(2)根据40℃时甲大于乙的溶解度,该温度下饱和溶液的溶质质量分数=
| 溶解度 |
| 溶解度+100g |
(3)根据20℃时甲的溶解度相等都等于30g,可知该温度下100g水中做多溶解30g该物质,所以A能溶得到的是饱和溶液;再加入20g甲能溶解10g,所以B饱和;加热至40℃时甲的溶解度为50g,说明100g水中在此温度下可溶解50克甲,只加了40g甲物质,所得溶液C为不饱和溶液;再加入20g甲能溶解10g,D溶液饱和;降温到20℃时,溶解度降低所得溶液E饱和.
解答:解:(1)图中点P是20℃时甲和乙的溶解度相等都等于30g;
故答案为:20℃时,甲和乙的溶解度相等;
(2)40℃时甲大于乙的溶解度,该温度下饱和溶液的溶质质量分数=
×100%,溶解度大则溶质质量分数大,所以甲的溶质质量分数大于乙的溶质质量分数;20℃时乙的溶解度等于30g,所以将50g乙物质放入100g水中,只能溶解30g乙物质,故所得溶液中,溶解的溶质与溶剂的质量比为3:10;
(3)20℃时甲的溶解度是30g,可知该温度下100g水中最多溶解30g该物质,所以A能溶得到的是饱和溶液;加入20g甲能溶解10g,B饱和.加热至40℃时甲的溶解度为50g,说明100g水中在此温度下可溶解50克甲,只加了40g甲物质,所得溶液C为不饱和溶液.再加入20g甲能溶解10g,D溶液饱和.降温到20℃时,溶解度降低所得溶液E饱和,据饱和溶液的溶质质量分数=
×100%,E溶液与B溶液中溶质的质量分数相同;
故答案为:AC;E.
故答案为:20℃时,甲和乙的溶解度相等;
(2)40℃时甲大于乙的溶解度,该温度下饱和溶液的溶质质量分数=
| 溶解度 |
| 溶解度+100g |
(3)20℃时甲的溶解度是30g,可知该温度下100g水中最多溶解30g该物质,所以A能溶得到的是饱和溶液;加入20g甲能溶解10g,B饱和.加热至40℃时甲的溶解度为50g,说明100g水中在此温度下可溶解50克甲,只加了40g甲物质,所得溶液C为不饱和溶液.再加入20g甲能溶解10g,D溶液饱和.降温到20℃时,溶解度降低所得溶液E饱和,据饱和溶液的溶质质量分数=
| 溶解度 |
| 溶解度+100g |
故答案为:AC;E.
点评:根据溶解度曲线的意义分析解答:从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同等,较好的考查了学生分析、解决问题的能力.

练习册系列答案
相关题目
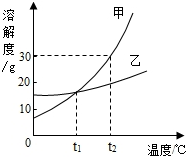 右图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )
右图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )| A、甲的溶解度随温度变化比乙小 | B、t2℃时甲的饱和溶液的溶质质量分数小于30% | C、t1℃时,甲、乙饱和溶液的溶质质量分数不相等 | D、可采用降低温度的方法使乙的饱和溶液变为不饱和溶液 |
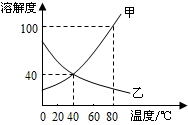
 (2007?长春)如图是甲、乙两种固体物质的溶解度曲线,据此判断以下说法正确的是( )
(2007?长春)如图是甲、乙两种固体物质的溶解度曲线,据此判断以下说法正确的是( )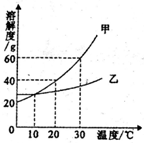 如图是甲、乙两种固体物质的溶解度曲线,下列叙述中正确是( )
如图是甲、乙两种固体物质的溶解度曲线,下列叙述中正确是( )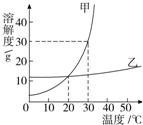 ?
?