题目内容
【题目】(本题共9分)碱式碳酸铜又称铜绿,是铜与空气中的氧气、二氧化碳和水等物质反应产生的物质。某化学兴趣小组同学发现Cu2(OH)2CO3受热分解后除生成CO2和 H2O外,试管中还有一些黑色粉末状固体。请结合所学知识,回答下列问题:
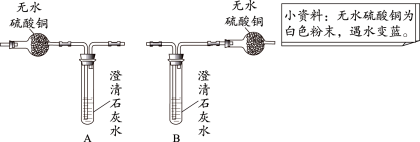
(1)若要证明有CO2和H2O生成,应选择下图的装置是 (填字母序号);理由是 。
(2)探究黑色粉末的成分。
【猜想与假设】
该黑色粉末可能是①碳粉、②氧化铜、③ ;
小明同学经过认真分析,认为上述猜想 一定不正确(填序号);其理由是 ;
【查阅资料】
a.碳粉与氧化铜均为不溶于水的黑色粉末;
b.氧化铜能与稀盐酸反应形成蓝色溶液;
c.碳粉既不与稀盐酸反应也不溶解在稀盐酸中。
【实验验证】
请你帮小组同学完成下述实验报告。
实验步骤 | 实验现象 | 实验结论 |
猜想②正确 |
(3)铜绿[Cu2 (OH)2CO3]受热分解的化学反应方程式: 。
【答案】(1)A 若用B装置则无法检验水的存在
(2)碳粉和氧化铜的混合物 猜想① 铜元素不守恒
【实验验证】
实验步骤 | 实验现象 | 实验结论 |
向黑色粉末中加入足量的稀盐酸 | 黑色粉末全部溶解,溶液呈蓝色。 | 猜想②正确 |
(3)Cu2(OH)2CO3△2CuO + H2O + CO2↑
【解析】
试题分析:(1)若要证明有CO2和 H2O生成,应选择下图的装置是A,理由是:若用B装置则无法检验水的存在,因为如果先检验二氧化碳,那么从澄清石灰水中出来的气体中就会含有水分,这样对水分的鉴定形成干扰
(2)根据猜想①碳粉、②氧化铜,故猜想③:碳粉和氧化铜的混合物;小明同学经过认真分析,认为上述猜想猜想①一定不正确,其理由是:根据质量守恒定律:在化学反应前后,元素的种类不变,若黑色固体时炭粉的话,那么铜元素不守恒
【实验验证】根据信息:氧化铜能与稀盐酸反应形成蓝色溶液,碳粉既不与稀盐酸反应也不溶解在稀盐酸中
实验步骤 | 实验现象 | 实验结论 |
向黑色粉末中加入足量的稀盐酸 | 黑色粉末全部溶解,溶液呈蓝色 | 猜想②正确 |
(3)根据上面的探究结果,铜绿[Cu2 (OH)2CO3]受热分解生成CO2和 H2O以及氧化铜,故化学反应方程式:Cu2(OH)2CO3△2CuO + H2O + CO2↑