题目内容
【题目】有一包粉末,已知其由BaCO3、Cu(NO3)2、Na2SO4、NaCl、NaOH中的几种组成,现对其做以下实验,各步骤均已经充分反应,请回答问题:
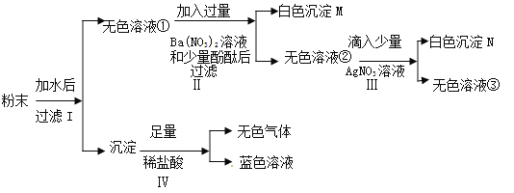
(1)请写出沉淀N的化学式: ;
(2)步骤Ⅱ所发生反应的化学方程式: ;
(3)无色溶液②中一定存在的溶质(酚酞除外)的化学式: ;
(4)请写出步骤Ⅳ中有气体生成的化学反应方程式,并注明基本反应类型:
; ;
(5)这包粉末中共含有 种物质。
【答案】(1)AgCl (2)Na2SO4+Ba(NO3)2=====BaSO4↓+2NaNO3(3)NaNO3、Ba(NO3)2、NaCl (答全得分)
(4)BaCO3+2HCl====BaCl2+H2O+CO2↑ 复分解反应 (5)五
【解析】
试题分析:粉末加水溶解后过滤的无色溶液和沉淀,沉淀加入足量的盐酸有无色气体和蓝色溶液产生,故沉淀中含有碳酸钡和氢氧化铜,说明混合物粉末中含有氢氧化钠、硝酸铜、碳酸钡;无色溶液中加入硝酸钡和少量的酚酞试液出现白色沉淀说明混有硫酸钠,过滤加入硝酸银溶液有白色沉淀氯化银,故含有氯化钠;故(1)写出沉淀N的化学式:AgCl;(2)步骤Ⅱ所发生反应的化学方程式:Na2SO4+Ba(NO3)2=====BaSO4↓+2NaNO3;(3)无色溶液②中一定存在的溶质为反应生成的硝酸钠、混有的氯化钠和过量的硝酸钡,其(酚酞除外)的化学式为:NaNO3、Ba(NO3)2、NaCl (4)请写出步骤Ⅳ中有气体生成的化学反应方程式,并注明基本反应类型:BaCO3+2HCl====BaCl2+H2O+CO2↑;复分解反应 ;(5)这包粉末中共含有五种物质。

练习册系列答案
相关题目