题目内容
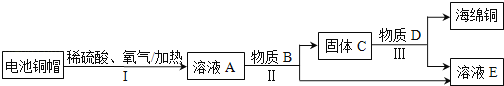
【题目】钨是熔点最高的金属,广泛用于钢铁工业、电真空照明材料等行业。黑钨矿的主要成分是铁和锰的钨酸盐(化学式为FeWO4、MnWO4),已知钨酸是一种难溶性酸,对热不稳定。用黑钨矿制取钨的工艺流程如下图所示:
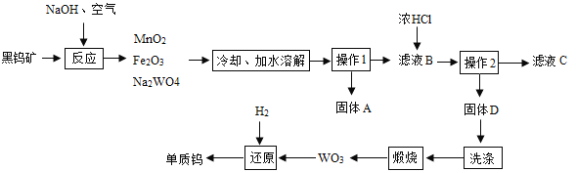
(1)FeWO4的名称是_____,钨酸的化学式为_____。
(2)如果在实验室里完成“操作1”,需要用到的玻璃仪器除漏斗、烧杯外,还有_____。
(3)“滤液B”中的主要离子是_____(填离子符号),“滤液B与浓盐酸反应的化学方程式为_____。
(4)H2在高温条件下还原三氧化钨(WO3)的化学方程式为_____。
(5)假设“滤液B”中的溶质的质量是aKg,那么,理论上可得到单质钨的质量是_____Kg(用含a的式子表示)。
【答案】钨酸亚铁 H2WO4 玻璃棒 Na+、WO42- Na2WO4 + 2HCl= 2NaCl+ H2WO4↓ WO3 + 3H2![]() 3H2O + W
3H2O + W ![]()
【解析】
(1)根据流程图中化学式Na2WO4和化合价规律可知,原子团WO4显-2价,则FeWO4中铁元素的化合价为+2价,根据盐的命名规则,FeWO4的名称是钨酸亚铁;钨酸的化学式为H2WO4;
(2)根据流程图可知,操作1是将固体与液体分离,操作1是过滤。如果在实验室里完成“操作1”,需要用到的玻璃仪器除漏斗、烧杯外,还有玻璃棒;
(3)MnO2和Fe2O3不溶于水,Na2WO4 是一种钠盐,能溶于水,在水中电离出Na+和WO42-。“滤液B”中的主要离子是Na+、WO42-,“滤液B与浓盐酸相互交换成分反应生成氯化钠和钨酸的沉淀,反应的化学方程式为Na2WO4 + 2HCl= 2NaCl+ H2WO4↓;
(4)H2在高温条件下还原三氧化钨(WO3)生成钨和水,反应的化学方程式为WO3 + 3H2![]() 3H2O + W;
3H2O + W;
(5)设:理论上可得到单质钨的质量是x。
根据化学方程式Na2WO4 + 2HCl= 2NaCl+ H2WO4↓,H2WO4![]() WO3 + H2O ,WO3 + 3H2
WO3 + H2O ,WO3 + 3H2![]() 3H2O + W可得:
3H2O + W可得: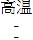
![]() x=
x=![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
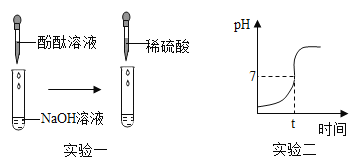
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
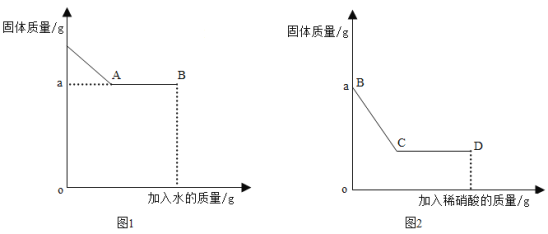
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。