题目内容
【题目】化学式一门神奇的学科,它可以变废为宝。某化学兴趣小组以锈蚀严重的废铜屑为原料,回收制取纯铜.
查阅资料:久置的铜制品表面能生成绿色的铜锈[主要成分为Cu2(OH)2CO3],
Cu2(OH)2CO3+2H2SO4═2CuSO4+3X+CO2↑,Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
如图是该兴趣小组设计的两种回收铜的实验方案:
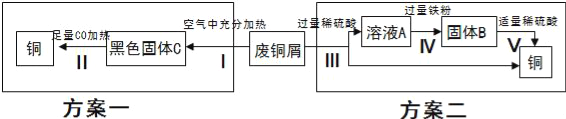
(1)X的化学式是____________。
(2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是_______________.
(3)步骤Ⅴ过程发生反应的化学方程式为______________.
(4)同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一______(填“>”或“=”或“<”)方案二.
【答案】 H2O 过滤 Fe+H2SO4=FeSO4+H2↑ =
【解析】(1)化学反应前后原子的种类个数不变,所以X的化学式是H2O (2)步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是过滤,因为过滤可以将难溶性固体与液体分离;(3)废铜屑与硫酸反应生成硫酸铜,所以溶液A的溶质为硫酸铜和硫酸。加入过量铁,铁将硫酸铜、硫酸完全反应,溶液中溶质为硫酸亚铁,固体为铜和铁,加入硫酸将铁除掉,步骤Ⅴ过程发生反应的化学方程式为Fe+H2SO4=FeSO4+H2↑,(4)两个方案中铜元素都来自于废铜屑,且都将铜元素转化成单质铜,所以最终得到的铜的质量相等。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目